Cánula nasal de alto flujo y nCPAP
Febrero 2016
Cánula nasal de alto flujo y presión positiva continua en vía aérea nasal y alimentación oral completa en neonatos con displasia broncopulmonar
Sandeep Shetty, Anne Greenough Arch Dis Child Fetal Neonatal Ed Febrero 2016
Professor Anne Greenough, NICU, King’s College Hospital, Denmark Hill, London , UK
Traducción libre : Dr Gerardo Flores Henríquez Pediatra Neonatólogo Puerto Montt Chile
¿ Qué se sabe sobre este tema ?
La cánula nasal de alto flujo humidificado (CNAF) se ha convertido en un modo cada vez más popular de asistencia respiratoria.
La presión positiva continua en vía aérea (CPAP) puede ser mal tolerada en neonatos de más edad con displasia broncopulmonar (DBP).
La coordinación de deglución y respiración ocurre aproximadamente a las 34 semanas de edad gestacional .
¿ Que añade este estudio ?
Entre los neonatos con DBP, aquellos apoyados por CPAP nasal (nCPAP) y luego CNAF en comparación con nCPAP tuvieron una alimentación oral completa más precoz.
Los RN que requieren soporte de presión > 34 semanas de Edad gestacional lograron alimentación oral completa antes en el grupo nCPAP / HHFNC.
Introducción
Los RN que nacen extremadamente
prematuros tienen riesgo de desarrollar displasia broncopulmonar (DBP-dependencia
de oxígeno más de 28 días). Tales neonatos pueden permanecer en soporte
respiratorio durante muchos meses, incluyendo la edad en que deberían ser
capaces de alimentarse por vía oral, lo cual es por lo general a las 34 semanas
de edad gestacional (PMA ó edad postmenstrual). La alimentación oral no se
intenta antes de las 32 semanas de PMA1 dado que la coordinación de
succión, deglución y respiración no se ha establecido. Respiración rítmica
durante la alimentación se adquiere por primera vez entre las 34 y las 36
semanas PMA.2
En una serie, 3 antes de las 34 semanas de EPM la deglución por lo general se produjo durante una pausa respiratoria y después de 35 semanas de EPM la deglución ocurrió normalmente al final de la inspiración. Además, la reducción de la frecuencia respiratoria durante la succión intermitente después de 34 semanas fue menor que a las 32 ó 33 semanas de edad gestacional.3-5
Con la cánula nasal de alto flujo humidificado, se entrega gas calentado y humidificado a altas velocidades de flujo entre 2 y 8 L / min a través de una cánula nasal. Se percibe que los neonatos están más cómodos y se manejan con mayor facilidad en CNAF que en presión positiva continua (nCPAP) .6
Los autores del presente estudio , por tanto, plantearon la hipótesis de que los niños con displasia broncopulmonar en CNAF serían alimentados completamente por vía oral antes que los que recibían apoyo por nCPAP. También plantearon la hipótesis de que cualquier diferencia en la alimentación podría ser más pronunciada en los neonatos que continúan requiriendo asistencia respiratoria con presión positiva después de 34 semanas de Edad gestacional.
El objetivo de este estudio fue probar
estas hipótesis comparando el tiempo requerido para la alimentación oral
completa entre neonatos con displasia broncopulmonar que eran apoyados por CPAPn
con aquellos que recibieron CPAPn y luego cambiados a CNAF .
Métodos
Se realiza una revisión de recién
nacidos antes de las 33 semanas de edad gestacional que desarrollaron DBP
(dependencia de oxígeno a 28 días7). Entre julio de 2011 y febrero de
2013, los neonatos con DBP post extubación fueron apoyados por nCPAP,
inicialmente a 6 cm H2O. A partir de marzo de 2013, los niños fueron extubados a
nCPAP (6 cm de H2O) y luego cambiados a CNAF si continuaban requiriendo nCPAP
por > 2 semanas y su requerimiento de oxígeno suplementario disminuía a < 40%.
Otras indicaciones para cambiar a CNAF eran si tenían traumatismo nasal ó se
percibía que no estaban tolerando nCPAP según evaluación subjetiva por el equipo
de matronería. El mismo protocolo de extubación se utilizó en los dos
períodos de tiempo. nCPAP fue entregada por el ventilador infantil SLE
2000, 5000 y la CNAF por el dispositivo de Fisher and Paykel usando Optiflow TM
Neonatal (Optiflow junior TM prematuro (OPT 312) y neonatal (OPT 314)) y en los
neonatos más grandes cánulas nasales infantiles (Optiflow junior TM infantil (OPT
316) y pediátricos (OPT 318)). Según la guía de práctica clínica de la
Unidad de los autores , en los neonatos cuyo peso actual era ≥ 1.5 kg se
inició CNAF a 8 L / min y en aquellos cuyo peso era < 1,5 kg a 6 l /
min.
A los neonatos en cualquiera de los métodos de apoyo sólo se les hizo weaning si
estaban clínicamente estables, no tenían un alto trabajo respiratorio, según lo
indicado por retracción y tenían requerimiento de FiO2 < 0,4. Las
presiones de CPAP fueron disminuídas (en weaning) cada 24-48 h en 1 cm de
H2O y los niños fueron cambiados a oxígeno suplementario a través de cánulas de
bajo flujo cuando estaban en CPAP 4 cm y FiO2 < 0,3 .
En CNAF, los flujos se redujeron en 0,5 a 1 L / min cada 24 - 48 horas si el requerimiento de oxígeno estaba entre 30% y 40% y 1 L / min si la FiO2 era < 0,3. Ellos fueron cambiados a oxígeno suplementario a bajo flujo cuando la velocidad de flujo era 3 L / min y estaban con FiO2 < 0,3.
Los neonatos con anomalías congénitas mayores y aquellos que no pudieron llegar a alimentación oral completa antes del alta hospitalaria fueron excluídos del análisis. Los neonatos fueron identificados a partir de una base de datos informatizada neonatal (Badgernet) y un registro de derivaciones al servicio de terapia del habla y del lenguaje (fonoaudiología).
La práctica de rutina no era alimentar a
los recién nacidos por vía oral en nCPAP debido a las preocupaciones de que la
presión aérea positiva continua entregada pudiera comprometer su capacidad de
proteger sus vías respiratorias durante la deglución. Además, los dispositivos
de nCPAP son engorrosos y restringen el acceso fácil a la boca del RN y, por
tanto, la introducción segura de los alimentos por vía oral. Los prematuros en
CNAF fueron referidos al servicio de Fonoaudiología desde las 34 semanas de
gestación para evaluar su disposición para hacer frente a la alimentación oral.
Los criterios utilizados para evaluar su disposición incluyen su trabajo
respiratorio, frecuencia respiratoria, tolerancia a la manipulación,
cualquier riesgo no respiratoria (o disfagia) y el resultado de la
evaluación de los reflejos oral y faríngeo y succión no nutritiva.
Los informes médicos fueron revisados de forma independiente por dos
investigadores y verificaron los datos. Se registraron la edad postnatal y edad
gestacional a las cuales se probó por primera vez la alimentación oral y cuando
se alcanzó la alimentación oral completa.
Además, se registró la duración de la
asistencia respiratoria, sea nCPAP ó nCPAP / CNAF, la longitud total de la
asistencia respiratoria y la estadía hospitalaria total (LOS). Los niños fueron
dados de alta cuando su peso era al menos 1,8 kg, se estaban alimentando
completamente por vía oral y estaban estables en aire ó bajo flujo de
oxígeno.
Análisis
Los datos fueron analizados para
normalidad usando test de Kolmogorov-Smirnov y se encontró que no se
distribuían normalmente. Por tanto, se evaluaron las diferencias entre los
dos grupos para significación estadística mediante la prueba de χ2 o la
prueba de Mann-Whitney, según procedía utilizando software estadístico SPSS de
IBM, V.22 (IBM Corporation, EE.UU.).
Un análisis más detallado se llevó a cabo en niños que requerían asistencia respiratoria con presión positiva (ya sea como nCPAP ó nCPAP / HHFNC) más allá de 34 semanas de EPM. Se realizó ajuste para diferencias en edad gestacional y duración de ventilación mecánica entre los dos subgrupos utilizando un modelo de regresión linear.
Resultados
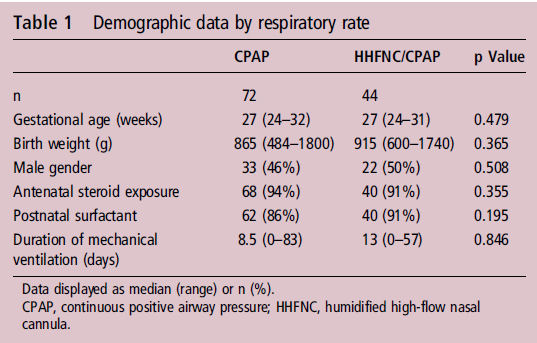
En total, se identificaron 116 niños con
DBP ; 72 recién nacidos en grupo nCPAP y 44 recién nacidos en grupo nCPAP / CNAF . No hubo diferencias significativas en cuanto a edad gestacional
ó peso al nacer de los dos grupos (tabla 1). La mediana de edad gestacional en grupo nCPAP fue de 27 (rango 24-32) semanas y
la mediana de peso
al nacer fue 865 (rango 484 -1800) g y en grupo nCPAP / CNAF la mediana de edad gestacional a fue 27 (rango 24-31) semanas y
la mediana de peso nacimiento 915 (600-1740) g (p = 0,479 y 0,365, respectivamente).
Tabla 1.- datos demográficos por frecuencia respiratoria

La edad PMA (p = 0,015) y la edad postnatal (p
= 0,012) a la cual se probó por primera vez la alimentación oral fue
significativamente más precoz en el grupo nCPAP / CNAF (tabla 2). El peso a las
36 semanas PMA fue significativamente mayor en grupo nCPAP / CNAF (p =
0,001) (tabla 2).
La longitud de la asistencia respiratoria (ya sea como nCPAP ó nCPAP / CNAF ) fue significativamente mayor en grupo nCPAP / CNAF (p = 0,003), pero la duración del oxígeno a bajo flujo fue significativamente mayor en el grupo nCPAP en comparación con el grupo nCPAP / CNAF (p = 0,035) (tabla 2). La duración total de la asistencia respiratoria no difirió significativamente entre los dos grupos.
Tabla 2 Outcomes según modo respiratorio
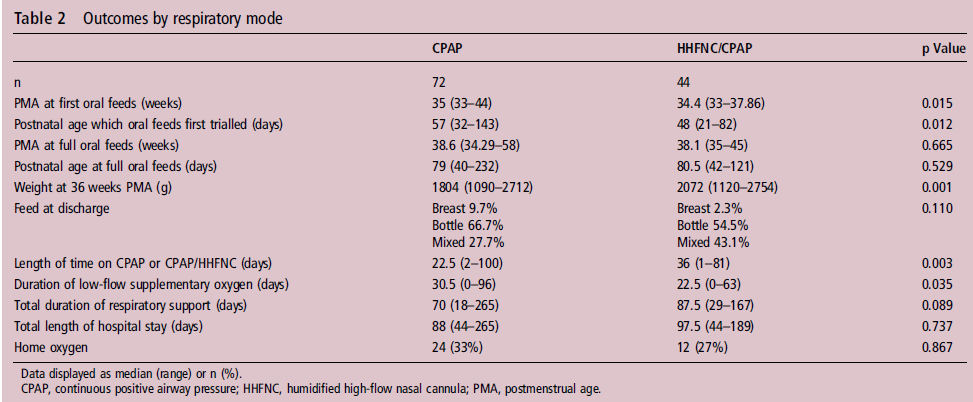
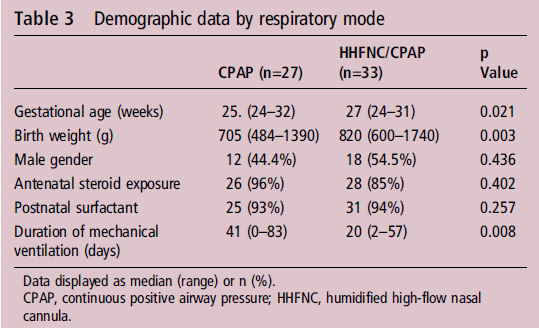
Había 27 niños en el grupo nCPAP y 33 recién nacidos en el grupo nCPAP / CNAF que necesitaron nCPAP ó nCPAP / CNAF más allá de 34 semanas de PMA (edad postmenstrual) (tabla 3). El grupo CPAP nacieron a una edad gestacional más temprana (p = 0,021) y fueron de menor peso al nacer (p = 0,003).
Tabla 3.- Demographic data by respiratory mode
La prueba de la primera alimentación oral y la edad para alcanzar alimentación oral completa fueron significativamente menores en grupo de nCPAP / CNAF (p < 0,001 y p < 0,001, respectivamente) (tabla 4).
Tabla 4.- Outcomes by respiratory mode in infants requiring non-invasive respiratory support after 34 weeks postmenstrual age (PMA)
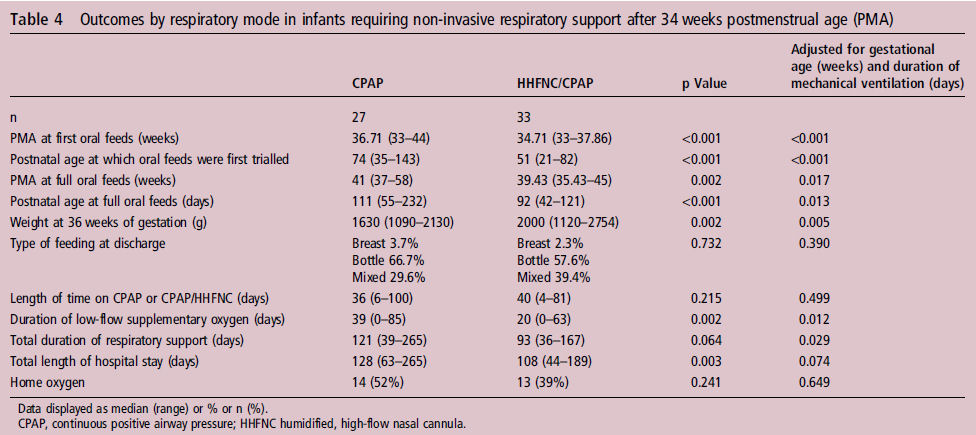
El peso a las 36 semanas PMA fue significativamente más alto y LOS (estadia hospitalaria) fue significativamente menor en el grupo nCPAP / CNAF (p = 0,002 y 0,003, respectivamente, tabla 2). Las diferencias siguieron siendo significativas para la edad de prueba de la primera alimentación por vía oral y edad para lograr alimentación oral completa, pero no para LOS, después de ajustar para diferencias en edad gestacional y duración de ventilación mecánica entre los subgrupos.
El tiempo para alcanzar alimentación completa por vía oral desde la primera prueba de alimentación oral no fue diferente entre los grupos globales (mediana de 20 (rango 7-114) días (CPAP) versus mediana de 27 (rango 8-72) días ( NCAF / CPAP), p = 0,07) ó entre los subgrupos (mediana 36 días (7-114) (CPAP) versus 28 (rango 8-72) días (CNAF / CPAP), p = 0,518).
Discusión
Los autores han demostrado que los
neonatos con DBP
tenían prueba de alimentación oral más precoz y tenían mayor peso a las 36
semanas de Edad gestacional cuando eran apoyados con nCPAP y luego CNAF en
comparación con CPAP. También
se encontraron diferencias significativas entre aquellos que requirieron asistencia
respiratoria con presión positiva más allá de 34 semanas de Edad gestacional,
aquellos apoyados por nCPAP y luego CNAF. Una revisión retrospectiva anterior demostró que los
neonatos apoyados por CNAF en comparación con CPAP lograron alimentación oral
completa más precozmente y recuperaron su peso de nacimiento más pronto.8
Este estudio fue diferente
del estudio que reportó actualmente en que sólo incluyó niños nacidos entre
25 y 30 semanas de gestación y que requirieron ya sea CNAF ó nCPAP en los
primeros 14 días después del nacimiento, mientras que el presente estudio reporta
outcomes
en recién nacidos con la DBO en evolución ó DBP establecida.
Entre los neonatos enrolados en un estudio randomizado de nCPAP ó CNAF ya sea
como terapia primaria ó post extubación, no se encontraron diferencias en el
tiempo para alcanzar alimentación oral completa.9
Similarmente, en otro estudio randomizado que compara el soporte postextubación con
CNAF ó nCPAP, no
se demostró diferencias significativas en los días para alcanzar alimentación enteral
completa.10
Sin embargo, la población de estudio del
presente paper , difiere
de las incluídas en los dos estudios, 9 y10 en que en el presente estudio se
estaba evaluando neonatos con DBP y se encontró las diferencias más significativas en los resultados en
recién nacidos que requerían apoyo respiratorio más allá de las 34 semanas de
gestación . A esa edad, los niños deberían estar siendo alimentados vía
oral. Los RN con
apoyo de CNAF en comparación con nCPAP son más accesibles para sus padres y el
personal y ésto puede explicar su logro más precoz de alimentación oral
completa y por lo tanto su longitud más corta de la estadía hospitalaria. Otra explicación
es que no se intentó la alimentación oral por succión si los niños estaban apoyados por
nCPAP,
mientras que los niños en CNAF se evaluaron desde las 34 semanas de gestación
por la Fonoaudióloga para ensayar su disposición para
hacer frente a la alimentación oral (succión). El retraso en la introducción de la
alimentación oral por succión en el grupo nCPAP podría haber causado en ellos
aversión por succión oral y que tuvieran mayores dificultades para
establecer la alimentación oral completa.
Se ha sugerido que la invasividad de largos procedimientos de
intubación y de suplementación de oxígeno disminuyen las experiencias sensoriales y motoras durante un período crítico del
desarrollo del cerebro para el pattern oromotor. 11 Se ha
observado que la estimulación oral acelera la transición desde alimentación por
sonda a alimentación oral por succión en prematuros. 12
Los autores del presente estudio no encontraron, sin embargo, que el tiempo necesario
para alcanzar la alimentación oral completa desde el primer intento ó ensayo de alimentación
oral fuese diferente entre los dos grupos o los dos subgrupos, lo que sugiere que
era el retraso en inicio la alimentación en el grupo nCPAP lo que causó su edad
más tardía edad en lograr la alimentación completa por vía oral.
En un estudio reciente, se compararon
los outcomes ó resultados entre RN con displasia broncopulmonar (37- 42
semanas de EPM) randomizados a alimentación por vía oral , mientras
estaban en nCPAP ó a ser alimentados exclusivamente por sonda nasogástrica
(gavage). Los RN
que fueron alimentados por vía oral, tuvieron adquisición más precoz de alimentación
oral completa, con un promedio de 17 días.13 El estudio sólo incluyó 53 recién
nacidos, pero sugiere que debe considerarse la posibilidad de evaluar los
neonatos con DBP estables con respecto a alimentación oral mientras se encuentren
en nCPAP.
La duración de nCPAP / CNAF fue
significativamente más larga que la duración de nCPAP, pero luego el grupo nCPAP requirió significativamente más tiempo en oxígeno
suplementario a bajo flujo. Además, la duración total de la asistencia respiratoria no fue
diferente entre los dos grupos. Los autores, por lo tanto, especulan que sus
resultados demuestran que el método utilizado para weaning de CNAF era
demasiado lento. Desafortunadamente, una reciente revisión sistemática Cochrane
encontró que no había estudios elegibles analizando la mejor estrategia para
weaning ó retiro de CNAF.14 Los autores14 concluyeron que es necesaria
investigación sobre la mejor estrategia para retiro de CNAF y a que subgrupos
aplicarla.
Hay ventajas y limitaciones a nuestro
estudio. Se utilizó una base de datos electrónica y apoyo de Fonoaudiología para
identificar a los pacientes. Todos los datos fueron comprobados por dos
investigadores de forma independiente. Los resultados no fueron generados a
partir de un estudio randomizado, sino por comparación de dos períodos de tiempo
sucesivos. Las características demográficas de los neonatos en general no
difirieron significativamente entre los dos grupos. Hubo, sin embargo, una
diferencia significativa en la edad gestacional y en la duración de la
ventilación mecánica de los dos subgrupos. Las diferencias en el tiempo para
alcanzar la alimentación oral
completa permanecieron significativas después de ajustar para esas
diferencias. Además, el único cambio en el manejo durante el período de estudio
fue la introducción de CNAF. Para nuestro conocimiento, éste es el primer
estudio que compara el tiempo para alcanzar alimentación oral completa entre niños
con displasia broncopulmonar que fueron apoyados exclusivamente por nCPAP con
aquellos que recibieron nCPAP y luego CNAF.
En conclusión, entre los niños con
displasia broncopulmonar, particularmente aquellos que requieren asistencia
respiratoria más allá de 34 semanas de gestación la alimentación oral se consiguió
más pronto y el aumento de peso fue mayor a las 36 semanas de gestación en los
apoyados por nCPAP / CNAF en comparación con aquellos en nCPAP. Los
autores destacan sus
datos derivados de una comparación histórica y esperan que ellos estimulan un
estudio randomizado. Se debe considerar evaluar neonatos con DBP estables con
respecto a la alimentación por vía oral, mientras estén en nCPAP.
Referencias
Lau C, Hurst N. Oral feeding in infants. Curr Probl Pediatr 1999;29:105–24.
Mathew OP. Science of bottle feeding. J Pediatr 1991;119:511–19.
Mizuno K, Ueda A. The maturation and coordination of sucking, swallowing, and respiration in preterm infants. J Pediatr 2003;142:36–40.
Lau C, Alagugurasamy R, Schanler R, et al. Characteristics of the developmental stages of sucking in preterm infants during bottle feeding. Acta Paediatr 2000;89:846–52.
Gewolb IH, Vice FL, Schweitzer-Kenney EL, et al. Developmental patterns of rhythmic suck and swallow in preterm infants. Dev Med Child Neurol 2001;43:22–7.
Ojha S, Gridley E, Dorling J. Use of heated humidified high-flow nasal cannula oxygen in neonates: a UK wide survey. Acta Pædiatr 2013;102:249–53.
Jobe AH, Bancalari E. Bronchopulmonary dysplasia. Am J Respir Crit Care Med 2001;163:1723–9.
Yoon SH, Young-hee K, Park HK, et al. High flow nasal cannula versus nasal CPAP in preterm infants. J Korean Soc Neonatol 2011;18:293–300.
Yoder BA, Stoddard RA, Li M, et al. Heated, humidified high-flow nasal cannula versus nasal CPAP for respiratory support in neonates. Pediatrics 2013;131: e1482–90.
Collins CL, Holberton JR, Barfield C, et al. A randomized controlled trial to compare heated humidified high-flow nasal cannulae with nasal continuous positive airway pressure postextubation in premature infants. J Pediatr 2013;162:949–54.
Hensch TK. Critical period regulation. Annu Rev Neurosci 2004;27:549–79.
Fucile S, Gisel E, Lau C. Oral stimulation accelerates the transition from tube to oral feeding in preterm infants. J Pediatr 2002;141:230–6.
Hanin M, Nuthakki S, Malkar MB, et al. Safety and efficacy of oral feeding in infants with BPD on nasal CPAP. Dysplagia 2015;30:121–7.
Farley RC, Hough JL, Jardine LA. Strategies for the discontinuation of humidified high flow nasal cannula (HHFNC) in preterm infants. Cochrane Database Syst Rev 2015;6:CD011079.