Hipertensión pulmonar
persistente neonatal (HPPN)
Diciembre 2013
Introducción
-
HPPN es el
resultado de falla de dilatación de circulación pulmonar al nacimiento.
-
Suele asociarse con enfermedad
del parénquima pulmonar, tal como aspiración de meconio, neumonía, enfermedad
por déficit de surfactante ó con enfermedades relacionadas con hipoplasia pulmonar
incluyendo hernia diafragmática congénita (HDC) u oligohidramnios mediado
por ruptura prematura de
membrana .
-
Incidencia : 1 - 2 niños por cada 1.000 nacidos vivos .
-
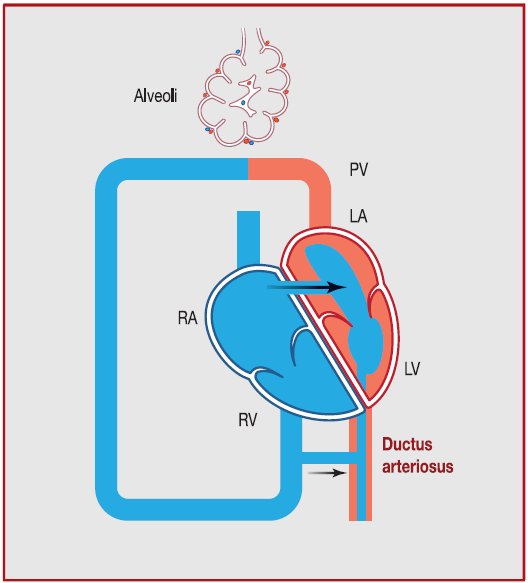 |
Figura 1.
Representación esquemática de circulación en HPPN. Elevación
mantenida de RVP è
bajo flujo sanguíneo pulmonar y alta presión
pulmonar
è
shunt extrapulmonar de derecha a izquierda de sangre a
través del ductus arterioso y foramen oval e hipoxemia severa.
|
-
La HPPN se asocia con frecuencia a baja
presión sistémica y bajo gasto cardíaco debido al aumento de la poscarga del
ventrículo derecho y disfunción miocárdica .
-
La insuficiencia
circulatoria inducida por HPPN es una condición que amenaza la vida pues
insuficiencia cardiaca afecta el aporte de oxígeno a los tejidos .
-
El manejo requiere reclutamiento pulmonar y ventilación alveolar adecuados,
óxido nítrico inhalado ( iNO) y reanimación con líquido y reanimación
cardiovascular apropiadas .
-
El inicio precoz de inotrópicos y
agentes vasoactivos se utiliza comúnmente para aumentar el gasto cardíaco ,
mantener presión arterial adecuada y mejorar el aporte de oxígeno al tejido.
Fisiopatología
Circulación fetal
-
La circulación pulmonar fetal se
caracteriza por alta RVP y bajo flujo sanguíneo .
-
Debido a alta RVP en el feto , la mayor parte del débito ventricular derecho cruza el
ductus arterioso hacia la aorta descendente , aumentando con ello el flujo
umbilical - placentario y el intercambio de gases.
-
Los mecanismos que mantienen alta RVP
en útero son :
-
Baja presión de oxígeno fetal
(PO2)
-
Falta de una interfaz gas- líquido
-
Producción de
mediadores vasoconstrictores como endotelina - 1 .
-
La producción de
óxido nítrico (NO ) también modula el tono vascular pulmonar fetal en respuesta
a diversos estímulos , incluyendo cambios agudos en las fuerzas
hemodinámicas.
Adaptación pulmonar al nacer
-
Al nacer, el cierre de
vasos umbilicales è
aumenta el flujo y presión sanguínea y causa
vasodilatación pulmonar aguda a través de la liberación de NO .
-
El principal estímulo para liberación de NO es la presión
de rozamiento o fuerza tangencial sobre la pared del vaso (shear stress), que se
genera por el aumento de flujo dentro de la arteria y que conduce a una
dilatación que es directamente proporcional al ON liberado por el endotelio.
-
El flujo sanguíneo
pulmonar aumenta dramáticamente , en 8 a 10 veces y la RVP cae inmediatamente
.
-
Varios estímulos contribuyen a la vasodilatación pulmonar al nacer ,
incluyendo :
-
Drenaje y absorción de líquido pulmonar fetal
-
Distensión rítmica del pulmón
-
Aumento de la PO2
-
Producción de varios productos vasoactivos , incluyendo NO .
-
El aumento del flujo sanguíneo
y la PaO2 aumentada y ventilación dependen de la activación de sintetasa de óxido nítrico ( NOS ).
-
El aumento de producción de NO es responsable de casi el 50 % de la abrupta caída de la RVP
al nacer en fetos de cordero .
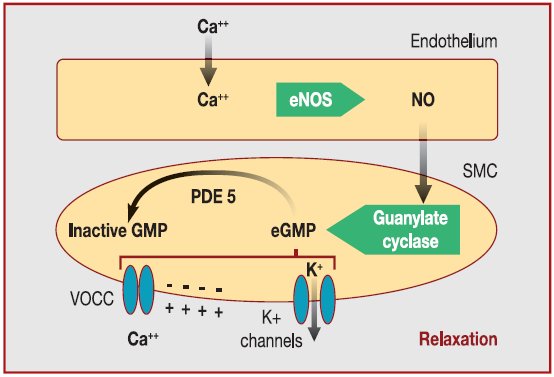 |
Figura 2. Vía NO /GMPc.
GMPc : monofosfato guanosina cíclico;
eNOS: sintetasa óxido nítrico
endotelial ;
PDE 5: fosfodiesterasa 5;
SMC: células
músculo liso |
-
NO, producido por la
SON endotelial, difunde hacia la célula del músculo liso donde
estimula a la Guanilato Ciclasa ==> aumento cGMP.
-
El GMPc ==> activación de
canales de K + ==> hiperpolarización de membrana de células del músculo liso
e inactivación de VOCC (canales de Calcio operados por voltaje) .
-
Cierre de
VOCC ==> disminución de concentración de Ca
+ + citosólico y relajación vascular.
-
El cGMP es
disminuído por actividad de la
fosfodiesterasa 5 (PDE 5) .
Mala adaptación de la circulación pulmonar al
nacer
La HPPN es un síndrome clínico que se asocia
con diversas enfermedades cardiopulmonares neonatales , incluyendo asfixia al
nacer, sepsis , aspiración de meconio y síndrome de dificultad respiratorio
ó puede ser idiopática.
Clínica de HPPN :
-
Hipoxemia refractaria inestable con gradiente de saturación
periférica pre y
postductal de oxígeno ( SpO2) .
-
La hipertensión pulmonar
puede estar asociada con hipotensión sistémica y síntomas de shock, llamado
shock " obstructivo " , cuyos signos clínicos y biológicos no son
específicos : color gris, taquicardia, llene capilar de más de 3
segundos , oliguria , hipotensión sistémica y acidosis láctica .
-
Se requiere Ecocardiografía
Doppler para determinar el componente principal del shock.
-
La
prioridad de manejo no es normalizar la SpO2 postductal, sino optimizar
la función circulatoria .
-
Se requiere una evaluación clínica y
ecocardiográfica rigurosa para el diagnóstico precoz de la insuficiencia
circulatoria.
Patogenia de HPPN :
-
Más relevante que los cambios en la SpO2 postductal ,
que refleja
shunt de derecha a izquierda a través del ductus arterioso , es la disminución de la SpO2
preductal la cual resulta de aumento en shunt derecha a izquierda a
través del foramen oval .
-
Este se produce cuando disminuye el retorno venoso pulmonar
( lo cual reduce la presión de aurícula izquierda) ó en caso de insuficiencia
cardíaca derecha ( que causa elevación de la presión de aurícula
derecha).
-
Ambos son marcadores de insuficiencia circulatoria potencial.
-
En la
mayoría de los casos , SpO2 baja postductal sóla ( es decir, con
SpO2 preductal normal ) no causa hipoxia tisular .
-
Por el contrario, una caída en
la SpO2 preductal se asocia generalmente con síntomas de shock y
concentración de lactato aumentada.
-
Los estudios experimentales de
hipertensión pulmonar crónica en animales recién nacidos han demostrado liberación endotelial de NO
alterada y producción aumentada de
vasoconstrictores ( por ejemplo, endotelina - 1 ) .
Factores de riesgo para HPPN : impacto
del medioambiente
Hay evidencia creciente
que indica que el medio ambiente fetal desempeña un papel crítico en mala
adaptación de circulación pulmonar al nacer.
Genética
-
Esta emergiendo un rol para la epigenética en
el desarrollo de hipertensión arterial pulmonar.
-
Los
mecanismos epigenéticos están implicados en la regulación de la expresión
génica, que son controlados, al menos en parte, por el medio ambiente.
-
En ratas
recién nacidas con hipertensión pulmonar, el aumento de expresión de NOS
endotelial se asocia con cambios en la regulación epigenética .
-
Tambien la hipertensión pulmonar se ha asociado con regulación epigenética
anormal de la superóxido dismutasa y el factor inducible por hipoxia.
-
VEGF
(vascular endothelial
growth factor)
es un potente mitógeno de células endoteliales y regulador de la angiogénesis
.
-
La inhibición in vivo de receptores de VEGF en fetos de ovejas
normales causa alteración de crecimiento vascular e hipertensión pulmonar .
-
El deterioro de la alveolarización y del crecimiento vascular en la hipertensión
pulmonar intrauterina crónica se asocian con una menor expresión de la proteína VEGF.
Exposición antenatal al tabaco
-
Concentraciones
de cotinina en sangre cordón - un marcador biológico de exposición a nicotina -
son más altas en niños
con hipertensión pulmonar persistente neonatal que en recién nacidos control sanos
.
-
El tabaquismo prenatal aumenta riesgo de HPPN en prematuros
< 30 semanas EG por efecto tóxico
sobre el desarrollo y maduración vascular pulmonar :
-
Cambios estructurales y funcionales
:
disminución de alveolos
y reactividad aumentada de las vías respiratorias.
-
Disfunción endotelial en
arterias intrapulmonares ==> vasoconstricción y proliferación
de células del músculo liso.
-
Vasoconstricción pulmonar potente y sostenida en feto y disminuye respuesta vasodilatadora a aumento en tensión de oxígeno.
-
Estos efectos
están asociados con marcada disminución en la oxigenación del feto ==>
fracaso de la circulación pulmonar para dilatarse al nacer.
Rol del stress ó dolor
-
Los corticosteroides y las catecolaminas son
las principales hormonas del estrés.
-
Tienen efectos beneficiosos sobre la maduración del parénquima pulmonar
, clearance del líquido pulmonar y liberación de surfactante pulmonar al
nacer .
-
Hormonas del estrés promueven la adaptación circulatoria normal al
nacimiento.
-
Varios estudios experimentales y clínicos han mostrado que la
norepinefrina mejora la circulación en el pulmón perinatal . En fetos de oveja ,
se ha demostrado que la norepinefrina aumenta el flujo sanguíneo pulmonar y reduce
la RVP . La norepinefrina induce una vasodilatación pulmonar dependiente de NO
en el feto ovino .
-
En un gran estudio retrospectivo de cerca de 30.000 partos consecutivos de más
de 7 años, la incidencia de hipertensión pulmonar persistente en recién nacidos
nacidos por cesárea electiva fue casi cinco veces mayor que entre los con parto
vaginal.
-
Una hipótesis probable para PPHN después de cesárea es que
puede ser una ventaja tener trabajo de parto y parto vaginal para el lecho
vascular pulmonar del recién nacido.
-
Un
aumento de las catecolaminas , especialmente norepinefrina , se observa al
nacer.
-
Sin embargo , las concentraciones de noradrenalina neonatales son
significativamente más bajas después de cesárea que después de un parto
vaginal .
-
Los niveles más bajos de norepinefrina circulantes después de
cesárea pueden explicar, al menos en parte, la alta incidencia de hipertensión
pulmonar persistente en recién nacidos por cesárea .
Exposición a fármacos
La administración de fármacos durante el
embarazo puede aumentar el riesgo de mala adaptación al nacer .
-
Probabilidad de HPPN aumenta
post exposición prenatal a aspirina u
otros fármacos antiinflamatorios no esteroidales .
-
Los mecanismos de HPPN : cierre
antenatal del ductus arterioso ó producción disminuída de la producción de prostaglandinas vasodilatadoras .
-
Administración
de ibuprofeno tiene el potencial para causar HPPN en
recién nacidos prematuros con conducto arterioso persistente.
Antidepresivos (fluoxetina) ==> remodelación vascular pulmonar e hipertrofia ventricular derecha en
ratas recién nacidas después de exposición materna a
fluoxetina.
-
En caso de insuficiencia respiratoria
grave , el inicio precoz de fármacos inotrópicos y vasoactivos es importante
para aumentar el gasto cardíaco , mantener presión arterial adecuada y
mejorar el aporte de oxígeno al tejido :
-
Dopamina es la amina
simpaticomimética más frecuentemente utilizada para shock séptico en recién nacidos .
-
Dopamina aumenta presión arterial sistémica.
-
Sin embargo dopamina
aumenta la presión de arteria pulmonar y la relación presión arterial
media pulmonar / presión arterial media sistémica en modelos experimentales y humanos.
-
Por lo tanto, se debe tener precaución en el uso de dopamina en recién
nacidos en riesgo de , ó con PPHN
Nutrición perinatal
-
Ha sido bien establecido que la obesidad
y la diabetes materna están asociadas con mayor riesgo de mala adaptación al
nacer. Los mecanismos incluyen asfixia
perinatal , enfermedades del parénquima y policitemia.
-
Los estudios han puesto
de manifiesto que los niños con hipertensión pulmonar persistente neonatal son
deficientes en el aminoácido , L - arginina , el cual se requiere para la síntesis
de NO .
-
Según ingesta de lípidos se pueden esperar efectos vasculares diferentes
: los aceites de
pescado dietéticos tienen efectos beneficiosos sobre la función cardiaca y
vascular , incluyendo efectos sobre las interacciones plaquetas /
pared vascular, función endotelial e inhibición de la proliferación celular
del músculo liso .
-
Los ácidos grasos poliinsaturados n3 (PUFAs) son
metabolizados por varias enzimas, incluyendo la ciclooxigenasa , para producir
prostaglandinas ( PGE3 , PGI3 ) ==> mediadores
vasodilatadores potenciales.
-
Además , los PUFA n3 compiten con el ácido araquidónico (PUFA
n6)
para conversión enzimática . Esta competencia disminuye la formación de
metabolitos vasoactivos del ácido araquidónico , como tromboxano A2 ,
un potente vasoconstrictor pulmonar . n3 PUFA inducen una vasodilatación pulmonar potente en el
pulmón perinatal .
-
La suplementación con PUFA n3 puede
ayudar a prevenir la mala adaptación al nacer , especialmente en condiciones con
hipertensión pulmonar prolongada tales como HDC ó hipoplasia pulmonar.
Oxígeno e hiperoxia
-
Mientras que el oxígeno estimula la
sintetasa de óxido nítrico endotelial (eNOS) y la producción de NO y contribuye a
la adaptación pulmonar al nacer , las altas concentraciones de oxígeno, tales como
las que se utilizan para tratar la hipertensión pulmonar persistente, pueden
producir especies reactivas del oxígeno.
-
Por ejemplo, peróxido de hidrógeno
(H2O2) podría disminuir la actividad promotora de eNOS, asociada con una
subregulación (a la baja) de la expresión de eNOS mediada por endotelina-1
.
-
Se ha demostrado que la ENOS
desacoplada aumenta los radicales superóxido, los cuales se
combinan rápidamente con NO para formar peroxinitrito, un potente
vasoconstrictor pulmonar y potencial toxina celular. Por otra parte, la
hiperoxia puede disminuir la vasodilatación pulmonar mediada por NO mediante el
aumento de actividad de la fosfodiesterasa 5.
Principios de manejo
Principios básicos
-
En HPPN con shunt derecha- izquierda a
través del ductus arterioso , la contribución de la hipoxemia a la oxigenación
tisular ( baja presión parcial de oxígeno en sangre arterial [ PaO 2 ] ) es
probable que sea modesta , siempre que SpO2 en el área preductal sea mayor que 80 % ,
la función circulatoria sea adecuada y la concentración de hemoglobina sea normal
. Del mismo modo , la hipoxemia durante la vida fetal ( SpO2 60-75 % ) ó durante
cardiopatías congénitas cianóticas no se asocia con hipoxia
tisular , siempre y cuando la función cardíaca sea normal .
-
Sin embargo , hay
alguna evidencia que sugiere que la disfunción cardíaca puede jugar un rol
importante en la HPPN :
-
La hipertensión pulmonar
severa aumenta postcarga del ventrículo derecho ==> puede causar
insuficiencia ventricular derecha.
-
La elevación resultante de presión telediastólica ventricular derecha causa
==> shunt derecha a izquierda
a través del foramen oval y empeora la hipoxemia .
-
Debido a un alto grado de
interdependencia entre los ventrículos derecho e izquierdo debido a la
presencia de estructuras comunes (el septo interventricular y el pericardio
inextensible ) , los cambios en el tamaño y geografía del ventrículo derecho
pueden alterar la función del ventrículo izquierdo .
-
Esto puede explicar por qué
la HPPN se asocia generalmente con baja presión
sistémica y bajo gasto cardíaco que requiere el uso de soporte cardiaco .
-
Ocurre insuficiencia del ventrículo derecho cuando el ductus arterioso se
cierra ó restringe .
-
En HPPN severa con derivación derecha a izquierda a través
del ductus arterioso , ambos, el ventrículo izquierdo y el derecho contribuyen al
flujo sanguíneo sistémico (Figura 3
) .
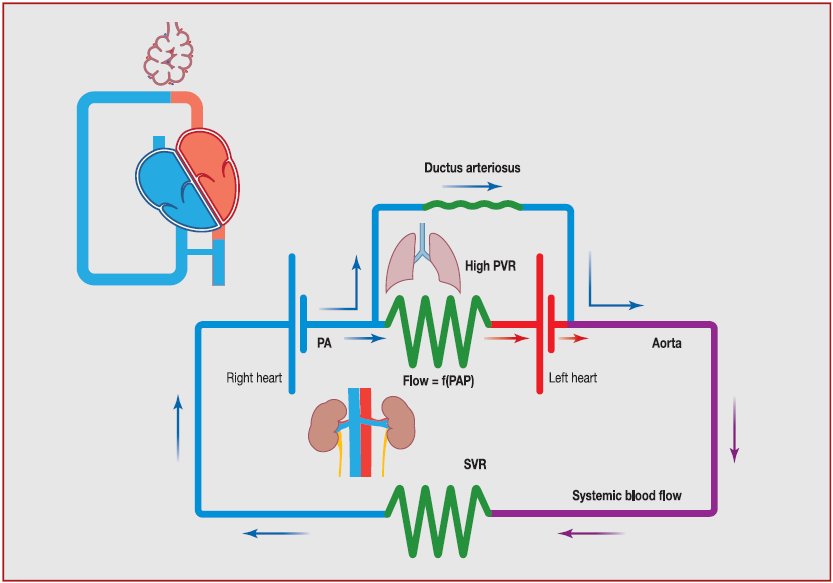
Figura 3. Representación esquemática de la
circulación en HPPN :
-
Debido a RVP elevada, parte del
débito ventrícular
derecho se dirige hacia la circulación sistémica a través del ductus arterioso ,
lo que contribuye al flujo sanguíneo sistémico .
-
A pesar de una caída de la SpO2 postductal mediada por shunt derecha a izquierda a través del conducto arterioso, el
aporte de oxígeno es generalmente adecuado, siempre y
cuando el ductus arterioso esté ampliamente permeable.
-
Ambas presiones
arteriales , la aórtica y la
pulmonar, están estrechamente relacionadas , cuando el ductus arterioso es
persistente ( baja resistencia ductal ) .
-
Por lo tanto , la presión aórtica
juega un rol crítico en la circulación pulmonar .
-
Una caída en la presión aórtica se
asocia con una disminución de la presión de la arteria pulmonar , y dado que
la presión arterial pulmonar es la fuerza motriz para el flujo sanguíneo
pulmonar, una disminución en la presión de arteria pulmonar inducida por presión aórtica puede empeorar la hipoxemia y la entrega de oxígeno .
-
Esta representación eléctrica destaca aún más que se requieren un conducto
arterioso persistente y función del ventrículo derecho normal para
mantener el flujo sanguíneo sistémico y aporte de oxígeno.
-
F ( PAP ) :
proporcional a presión de la arteria pulmonar ; PA : arteria pulmonar ; PAP :
presión arterial pulmonar , PVR : resistencia vascular pulmonar
; SVR : resistencia vascular sistémica
-
Por lo tanto , el manejo del neonato con
HPPN requiere reducción de la RVP y apoyo de la función
cardiovascular ( Tabla 1
)
Tabla 1.- Pasos en el manejo de HPPN.
|
Paso |
Acción |
|
1 |
Prevenir exposición a factores medioambientales que pueden empeorar
HPPN (ej;
stress, estímulos doloroso, ruido, luz excesiva,
sobredistensión pulmonar )
|
|
2
|
Proporcionar adecuada expansión y ventilación pulmonar |
|
3 |
Proporcionar óxido nítrico inhalado |
|
4
|
Evaluar hemodinamia (examen clínico, Rx tórax ,
índice cardiotorácico, ecocardiografía doppler) |
|
5 |
Proporcionar
adecuada expansión de fluídos y soporte vasoactivo de acuerdo al
principal componente de la insuficiencia circulatoria (obstructiva, hipovolémica,
distributivo ó cardiogénico) |
|
6
|
Puede requerirse
ECMO en shock obstructivo que amenaza la vida.
|
Factores medioambientales
-
En primer lugar, se debe evitar la
exposición a factores ambientales que empeoran HPPN.
-
Los estímulos nocivos,
incluyendo estímulos táctiles, aspiración traqueal y punciones del talón
tienen que limitarse tanto como sea posible.
-
Una escala de dolor específico para
neonatos se debe utilizar para titular la analgesia y optimizar su
entorno (reducir ruido y luz, "cocooning" ó capullo).
-
La sobredistensión de los
pulmones contribuye a una disminución en el flujo sanguíneo pulmonar y se debe
evitar, en particular, en condiciones asociadas con hipoplasia pulmonar (HDC y
ruptura prematura de membranas).
-
La Policitemia - mediada por viscosidad sanguínea
aumentada y aumento de presión arterial pulmonar - debe ser corregida.
Ventilación mecánica
-
El manejo requiere adecuado reclutamiento
pulmonar y adecuada ventilación alveolar , fluído apropiado y reanimación
cardiovascular y uso de vasodilatadores pulmonares.
-
En HDC ,
evitar
ventilación con mascarilla durante la reanimación en sala de
partos para prevenir la distensión de intestino situado en la cavidad torácica.
-
Deben evitarse las
altas presiones de las vías respiratorias para evitar barotrauma pulmonar , manteniendo saturación de oxígeno preductal mayor
de 85 % y presión parcial de dióxido de carbono en sangre
arterial ( PaCO2 ) de 40-55 mmHg .
-
Establecer límites a las presiones ventilatorias para evitar sobredistensión
pulmonar y aceptar gases sanguíneos adecuados más bien que óptima PaCO2 y PaO2 , siempre y cuando haya
evidencia de gasto cardíaco y función de órganos adecuados.
Los niños con shunt derecha - izquierda significativo requieren tratamiento
vasodilatador pulmonar.
-
iNO para los niños con
hipertensión pulmonar persistente ==> mejora outcomes en RN a término
y cercanos a término hipoxémicos mediante la reducción de incidencia del
outcome combinado de muerte ó necesidad de oxigenación extracorpórea ( ECMO
) .
-
La oxigenación mejora en aproximadamente 50 % de los recién nacidos que
recibieron iNO [ 55 ] .
-
Las concentraciones habituales
de iNO para tratamiento de HPPN son 5-20 ppm
Soporte de función cardiovascular
-
Inicio precoz de agentes inotrópicos y
vasoactivos para aumentar el gasto cardíaco, mantener
presión arterial adecuada y mejorar la entrega de oxígeno a los tejidos.
-
La hipotensión sistémica es generalmente
mal tolerada, con empeoramiento de la
hipoxia explicado por :
-
Disminución en el llene del ventrículo
izquierdo que causa disminución en la entrega de oxígeno a
los tejidos;
-
Disminución en el flujo coronario
-
Caída de presión pulmonar que
causa disminución de flujo sanguíneo pulmonar
-
Dado que ductus arterioso es
generalmente persistente en recién nacidos con hipertensión pulmonar
persistente, la presión de la arteria pulmonar y la presión aórtica están
estrechamente relacionadas (Fig. 3).
-
Una disminución en la caída de presión
de arteria pulmonar mediada por la presión sistémica causa disminución en el
flujo sanguíneo pulmonar, dado que Flujo = f (Presión). Por lo tanto, se requiere
una cuidadosa evaluación de la hemodinamia (examen clínico, radiografía de
tórax, índice cardiotorácico y ecocardiografía) en HPPN para proporcionar un
tratamiento óptimo.
-
En neonato pueden haber 4 tipos de shock, de acuerdo con el mecanismo principal responsable de
insuficiencia cardiocirculatoria :
-
Hipovolémico
: reanimación con líquidos
-
Cardiogénico
: evento raro en HPPN siempre y cuando el ductus arterioso esté ampliamente permeable -
puede requerir infusión de fármacos inotrópicos (dobutamina).
-
Vasopléjico ó distributivo
: vasoactivos
-
Obstructivo :
vasoactivos
ECMO
Criterios de indicación de ECMO :
-
SpO2 preductal menor 80% a pesar
de presión inspiratoria máxima superior a 28 cm H2O (ó presión media
de vía aérea mayor 15 cm de H2O en VAFO);
-
HPPN e insuficiencia circulatoria
resistentes a manejo adecuado
-
Edad gestacional mayor de 34 semanas;
-
Peso al nacer superior a 2 kg
Fármacos dilatadores pulmonares
-
Existe experiencia limitada en HPPN
con otros vasodilatadores pulmonares farmacológicos.
-
Los inhibidores de la fosfodiesterasa reducen la degradación del cGMP producido
vía
endógena ó por iNO.
-
Sildenafil mejora el gasto
cardíaco y función respiratoria mediante la reducción de hipertensión
pulmonar refractaria a iNO en siete recién nacidos con HDC .
-
En
hipertensión pulmonar crónica asociada con hernia diafragmática congénita , se
ha encontrado que sildenafil mejora la función vascular pulmonar y promueve el
crecimiento pulmonar.
-
Existe evidencia de que el sildenafil
es bien tolerado en el recién nacido con HPPN . Un meta -análisis de tres
estudios que incluyeron 77 recién nacidos con HPPN ha indicado que el sildenafil
puede mejorar la oxigenación y reducir la mortalidad .
-
Los resultados del meta
-análisis sugieren que el sildenafil en el tratamiento de la HPPN tiene un potencial significativo , especialmente en
escenarios con recursos limitados.
-
El uso de prostaciclina y análogos es una terapia establecida para niños
y adultos con hipertensión pulmonar primaria .
-
En un reciente estudio basado en
población , el uso de prostaciclina , junto con varias otras medidas , se ha
asociado con alta tasa de sobrevida.
-
Se ha encontrado que treprostinil
subcutáneo mejora los síntomas funcionales en niños pequeños con
hipertensión arterial pulmonar refractaria.
-
Sin embargo , su uso en HPPN
no ha sido reportado.
-
Existe evidencia de que el bloqueo del receptor de endotelina puede
mejorar el flujo sanguíneo pulmonar en HPPN.
-
En
un modelo experimental de hipertensión pulmonar fetal , el bloqueo intrauterino
del
receptor de endotelina disminuyó la presión arterial pulmonar , disminuyó la hipertrofia del ventrículo derecho y
la muscularization distal de las
pequeñas arterias pulmonares y aumentó la caída de la RVP en el parto.
-
Bosentan es un inhibidor no específico de
receptor de endotelina - 1 que mejora
la hipertensión pulmonar en pacientes
adultos .
-
Aunque reportes
recientes sugieren que bosentan puede mejorar HPPN , aún no hay pruebas
suficientes para apoyar el uso de bosentan en el manejo de HPPN.
Conclusiones
-
Cada vez más evidencia indica que el
entorno perinatal desempeña un papel clave en el fracaso de la transición
cardiopulmonar a circulación pulmonar adecuada al nacimiento.
-
La reducción de la
exposición a factores de riesgo debe ser el primer paso en la prevención de la
hipertensión pulmonar persistente .
-
La HPPN causa hipoxemia mediante shunt extrapulmonar derecha a izquierda.
-
La
prioridad del manejo debe ser optimizar la función circulatoria en lugar de
normalizar SpO2 postductal, dado que la insuficiencia circulatoria inducida
por HPPN es una
condición que amenaza la vida .
-
El manejo de HPPN requiere reclutamiento
pulmonar y ventilación
alveolar adecuadas , iNO y fluido y reanimación cardiovascular adecuados.
-
El inicio
precoz de agentes inotrópicos y vasoactivos se utiliza comúnmente para
aumentar el gasto cardíaco , mantener la presión arterial adecuada y mejorar el
aporte de oxígeno al tejido .
-
Sin embargo , se requiere una evaluación
clínica y ecocardiográfica rigurosa para el manejo óptimo de insuficiencia
circulatoria asociada a hipertensión pulmonar persistente.
Flujograma HPPN
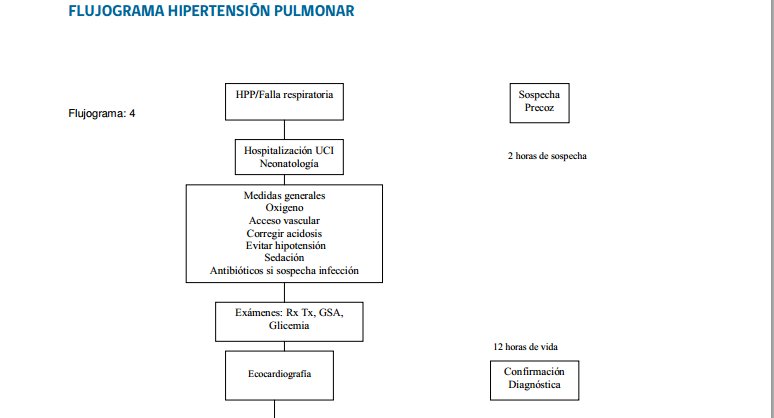
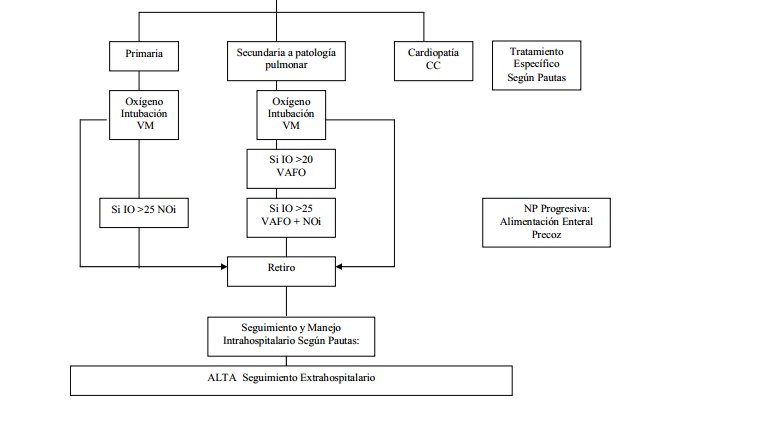
Indicación Oxido nítrico inhalado
-
RN ≥ 34 semanas y < 15 días
de vida con SDR
-
Hipertensión pulmonar
persistente diagnosticada con Ecocardiografía realizada por Cardióloga
infantil que descarta Cardiopatía Congénita
-
IO > de 25 con :
IO = PMVA x FiO2
PaO2
-
PAM > 60 mmHg (Dopamina
: 10 - 20 ug/kg/minuto )
-
Sedación con Fentanyl
-
Ventilación mecánica
convencional ó VAFO que asegure PaCO2 35-45 mmHg
-
Iniciar con 20 ppm
-
Previa toma de 1 gas
sanguíneo arterial y Metahemoglobina (calcular IO).
-
30 minutos después : Gas
sanguíneo arterial (calcular IO) y anotar saturación (debe ser 20 % más)
.
-
Si no hay respuesta subir
a 40 ppm y luego de 30 minutos : gas sanguíneo arterial (calcular IO) y
ver ascenso de saturación de O2 en más de 20 %.
-
Si mejora SpO2 postductal
> 92 % y oxemia en los gases sanguíneos arteriales mantener dosis por 4
- 6 horas .
-
Luego de 6 horas de óxido
nítrico disminuir de 5 ppm cada 30 minutos siempre que sature > 92 %
postductal y no modificar las medidas generales.
-
Al lograr dosis mínima (5
ppm) mantener por 24 horas con 1 ppm y tomar gas sanguíneo arterial
(calcular IO) y metahemoglobinemia .
-
Para el retiro del
paciente de iNO el paciente debe estar con FiO2 menor ó igual a 0.50.
Para suspender el Oxido nítrico inhalado






