Hipertensión pulmonar neonatal
Abril 2012
Manejo de la hipertensión pulmonar neonatal
Rami Dhillon ;
Department of Cardiac Services, Birmingham Children’s Hospital, Steelhouse
Lane, Birmingham
Arch Dis Child Fetal Neonatal Ed 2012; 97 :F223–F228
Introducción
La presión arterial pulmonar normal
es
virtualmente
independiente de la edad
fuera del período neonatal,
con una media de
14 ±
3 mm
Hg.3
Sin embargo, esta definición de HP no es válida en el recién nacido, porque incluso en circunstancias normales, nacemos con relativa hipertensión pulmonar.
In útero, los pulmones están llenos con líquido amniótico y no participan en el intercambio gaseoso. La resistencia vascular pulmonar (RVP) es alta, alrededor de 10 veces los niveles del recién nacido. La resistencia vascular sistémica es baja en virtud de la circulación placentaria. El foramen oval y el ductus arterioso sirven para bypass la alta resistencia vascular pulmonar .
Los dos influencias principales en la disminución normal de la RVP al nacer son cambios fisiológicos en respuesta a :
Activación de los receptores de estiramiento después de la inflación pulmonar con el inicio de respiración
Potente efecto del oxígeno como vasodilatador pulmonar.
Si bien hay una caída rápida en RVP al nacer , demora hasta 6 semanas caer a los niveles normales del adulto.
La presión de arteria pulmonar es el producto del flujo sanguíneo pulmonar y la resistencia vascular pulmonar (igual que voltaje eléctrico se relaciona con la corriente y la resistencia, tal como se describe por la ley de Ohm).
Por tanto, HP puede ser resultado de RVP elevada, flujo sanguíneo pulmonar aumentado ó combinación de ambas.
En el recién nacido, la HP suele ser resultado de una falla en la caída de la RVP a niveles normales al nacer, por tanto, hipertensión pulmonar persistente del recién nacido (HPP).
En segundo lugar, HP clínicamente importante se observa en la práctica neonatal en el contexto de la displasia broncopulmonar (DBP). Menos comúnmente, se puede encontrar con formas específicas de cardiopatía congénita. Estos tres grandes grupos de HP neonatal se analizan en la tabla 1.
Tabla 1 .- Principales causas de hipertensión pulmonar neonatal
| Grupo | Descripción |
| A | Hipertensión pulmonar persistente neonatal (HPPN) |
| i. Vasoconstricción pulmonar — ej; sindrome de aspiración meconial | |
| ii. Remodelamiento vascular pulmonar anormal — HPPN idiopática | |
| iii. Lecho vascular pulmonar disminuído — hipoplasia pulmonar | |
| B | Estenosis de venas pulmonares |
| C | Hipertensión pulmonar secundaria a cardiopatía izquierda |
| D | Hipertensión pulmonar secundaria a enfermedades pulmonares y/o hipoxia |
La acidosis y la hipoxia alveolar son estímulos potentes para la vasoconstricción pulmonar y puede haber exacerbaciones graves en la forma de crisis de hipertensión pulmonar.
Anormalidades histopatológicas del lecho vascular pulmonar en HP :
Puede haber muscularización anormal (remodelación) del lecho vascular pulmonar con extensión de la hipertrofia de vasos medianos hacia los más pequeños, normalmente vasos no musculares.
Cambios fibróticos e inflamatorios son prominentes en los neonatos con DBP, afectando no sólo el parénquima alveolar, sino también el lecho arteriolar
Diagnóstico de HP
El ECG es
útil
en búsqueda de
hipertrofia
ventricular derecha
como
característica
de HP
establecida, pero
no puede ser usado
para
descartarla.
La base del diagnóstico de HP es la ecocardiografía, que también sirve para excluir anomalías cardíacas estructurales, particularmente estenosis de la vena pulmonar.
Ecocardiografía Doppler
La ecocardiografía Doppler se basa en la reflexión de los ultrasonidos sobre eritrocitos en movimiento para medir la velocidad del flujo transvalvular dentro de las cámaras cardíacas y a través de los grandes vasos.
Los distintos colores indican la dirección del flujo sanguíneo (el azul hacia el transductor y el rojo en dirección opuesta); aparece además un color verde cuando el flujo es turbulento.
La ecocardiografía Doppler de onda continua permite determinar velocidades elevadas del flujo sanguíneo como sucede en presencia de estenosis valvular, insuficiencia valvular o cortocircuitos intracardíacos.
Estas velocidades elevadas se utilizan para determinar los gradientes de presión intracardíaca con ayuda de una modificación de la ecuación de Bernoulli:
Cambio de presion = 4 x (velocidad)²
El gradiente de presión derivado se emplea para determinar la presión intracardíaca y la gravedad de la estenosis.
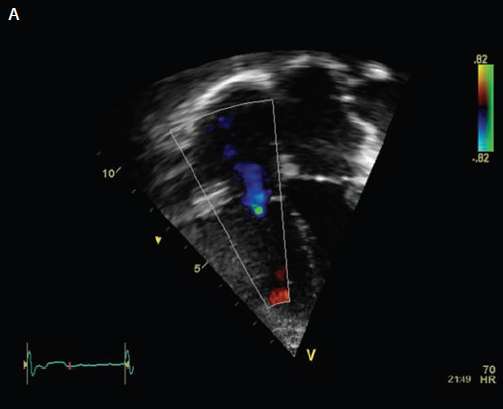
Figura 1 .- Uso de Ecocardiografía Doppler de onda continua para medir presión de ventrículo derecho
(A) Mapa de flujo a color de regurgitación tricuspídea (RT) en ecocardiografía.

A.- Por convención en Ecocardiografía un flujo que avanza es de color rojo y un flujo reverso (retrocede) es de color azul. Lo normal es que el flujo vaya de AD a VD , por tanto color rojo. En la imagen el flujo reverso (azul) llega hasta casi el tope de aurícula ==> importante. Me posiciono en punto verde y aparece imagen B.
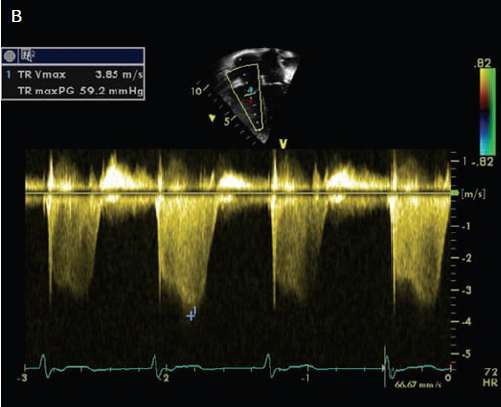
(B) Espectro Doppler : Normalmente el flujo tricuspídeo es (+), desde línea 0 hacia arriba. En la imagen se ve flujo reverso (hacia abajo ó negativo) hasta - 3.85.
Hay aumento de presión en forma retrógrada y aumenta presión de VD ==> gradiente de presión con aurícula derecha.
En casos de insuficiencia tricuspídea (IT) medible con onda Doppler continua, la ecuación de Bernoulli modificada para diferencia de presión ventrículo derecho - aurícula derecha ofrece una estimación de la presión sistólica del ventrículo derecho y en ausencia de obstrucción del tracto de salida del ventrículo derecho, de la presión sistólica de arteria pulmonar (diferencia de presión = 4 × Velocidad IT 2, figura 1).
En el ejemplo la velocidad máxima de IT es 3.85 m/seg y elevada al cuadrado es 14.8 y multiplicada por 4 es igual a 59.2.
Por convención sumo 10 a la gradiente y tengo una presión de VD (ó sea presión arteria pulmonar) = 70.
Manejo de tipos específicos de
HP
Hipertensión pulmonar persistente neonatal
El fracaso de la
RVP
a caer
después del nacimiento es
el mecanismo más común
en la presentación de
HP
neonatal.
Afecta
principalmente a
neonatos
en ó cerca de
término.
La incidencia es 1 - 2
por 1.000 nacidos vivos,
puede ser tan alta como
7
por cada 1.000
nacidos vivos.
La incidencia
en neonatos
con trisomía 21
es, posiblemente,
aún más alta,
hasta 12 por cada 1.000
NV.
La mortalidad en
los RN afectados
es elevado,
alrededor de 10-20%.
La fisiopatología se divide convencionalmente en tres variedades.
En la primera de ellas la vasculatura pulmonar está anormalmente contraída debido a enfermedades del parénquima pulmonar y sus asociadas hipercapnia, acidosis e hipoxia alveolar. El sindrome de aspiración de meconio es la causa más común y afecta hasta un 2% de los nacidos vivos y hasta un 5% de los bebés de término ingresados a UCIN. Otras causas incluyen la neumonía y síndrome de distress respiratorio (EDS). Hay acidosis e hipoxemia refractaria al oxígeno suplementario y ventilación.
En el segundo subgrupo, el pulmón tiene parénquima normal, pero hay remodelación anormal de la vasculatura pulmonar, también conocida como HPPN idiopática. La radiografía de tórax suele mostrar disminución de la vasculatura pulmonar y poco ó ningún cambio en el parénquima pulmonar. En estos casos, la ecocardiografía es particularmente útil en confirmar el diagnóstico y descartar cardiopatía congénita cianótica.
La administración a la madre de fármacos antiinflamatorios no-esteroidales (AINE) podían contribuir a hipertensión pulmonar persistente neonatal a través de cierre ductal prematuro una serie de casos neonatales humanos se han reportado, relacionados con el uso de AINE en la madre en el último trimestre de embarazo . También ha habido sugerencias de que la HPPN puede estar relacionada con el uso materno de inhibidores selectivos de la recaptación de serotonina (ISRS como los antidepresivos fluoxetina, sertralina).
Menos comúnmente, pero asociada con la mortalidad más alta, la vasculatura pulmonar es hipoplásica, en presencia de hipoplasia pulmonar, como se ve en la agenesia renal y hernia diafragmática congénita (HDC).
En esta situación, hay un lecho vascular pulmonar anormal y una RVP aumentada. La agenesia renal bilateral tiene un pronóstico extremadamente pobre, con la mayoría de los RN sobreviviendo no más de unas pocas horas. Con menores grados de displasia renal y oligohidramnios, la hipoplasia pulmonar puede no ser tan severa como para ser incompatible con la sobrevida. El pronóstico para la HDC ha mejorado constantemente en los últimos años, con sobrevida alta actualmente reportada en 85%.
Manejo de la HPPN
Clásicamente,
dentro de pocas horas
del nacimiento del
RN con
hipertensión pulmonar
persistente
estará mal perfundido
y
cianótico,
a menudo de
forma marcada, con saturaciones
postductales
incluso inferiores a
la preductal,
como resultado del
shunt de
derecha-izquierda
a nivel
ductal.
El diagnóstico
diferencial incluye
sepsis severa y
cardiopatía congénita cianótica.
Generalmente se administra oxígeno suplementario en una etapa temprana y la cianosis es probable que sea refractaria, lo que lleva a una escalada de la terapia, involucrando in icialmente la ventilación con presión positiva.
El tratamiento estándar incluye la corrección de la hipotermia, junto con analgesia, sedación y comúnmente paralización. El surfactante también es comúnmente usado. La postcarga del ventrículo derecho está aumentada y el uso de inótropos no es inusual. La acidosis debe ser corregida, al ser un potente estímulo para la vasoconstricción pulmonar.
El uso de alcalinización a pesar de una práctica generalizada, es más discutible.
Aparte de estas medidas generales, hay una serie de terapias específicas.
1.- Ventilación de alta frecuencia oscilatoria
El manejo inicial
de la
hipertensión pulmonar
persistente neonatal
generalmente implica
ventilación convencional
con presión positiva
(VC),
pero contribuye
a daño pulmonar
y enfermedad pulmonar crónica.
En teoría,
mediante mantener
oxigenación y
ventilación con mínimos
volúmenes tidales,
la ventilación de alta
frecuencia oscilatoria (VAFO)
minimiza el volutrauma
pulmonar y
por lo tanto reduce
el daño pulmonar.
Los estudios experimentales
en animales han
apoyado este
beneficio.
Sin embargo, dos recientemente actualizadas revisiones sistemáticas Cochrane han fallado en encontrar un beneficio claro de la VAFO sobre la VC . Específicamente, hubo falta de evidencia de reducción de la la mortalidad, fracaso del tratamiento, lesión intracraneal ó desarrollo de DBP.
En el prematuro, hubo una reducción borderline en DBP. Se necesita más trabajo en esta área para establecer la potencial eficacia de esta tratamiento sobre la VC.
2.- Oxido nítrico inhalado
El óxido nítrico es
un
vasodilatador
endógeno que
también
inhibe el crecimiento
del músculo liso y la
agregación plaquetaria.
Actúa a través de la estimulación de la guanilato ciclasa soluble y la producción de guanosina 3 ', 5'- monofosfato cíclico (GMPc).
Por inhalación, tiene un efecto selectivo sobre la vasculatura pulmonar y ha llegado a ser bien establecida como una terapia para HPPN.
También se ha demostrado que tiene efectos broncodilatadores y antiinflamatorios. Tiene un beneficio añadido sobre los vasodilatadores pulmonares por vía intravenosa u oral, ya que puede mejorar en lugar de exacerbar los efectos del desequilibrio entre ventilación y perfusión (figura 2).
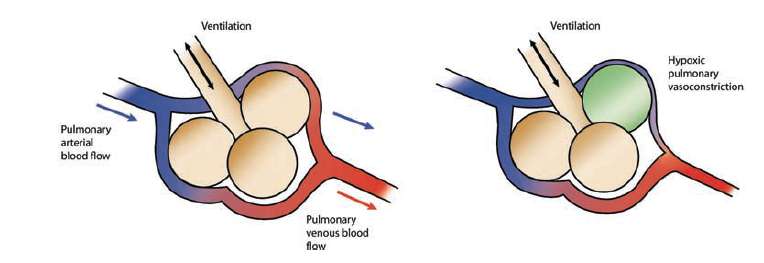
Figura 2.- Efecto protector de la vasoconstricción pulmonar hipóxica. En la segunda imagen, la arteriola pulmonar que irriga el alvéolo mal ventilado (en verde) se contrae para reducir la alteración de V/Q /ventilación/perfusión) .
La revisión sistemática Cochrane que abordó el uso de óxido nítrico inhalado (iNO) en recién nacidos a término concluyó que hay un claro beneficio en términos de rápida mejoría de los índices de oxigenación y evita la necesidad de oxigenación por membrana extracorpórea (ECMO), aunque la mortalidad no se vió afectada.22 Sin embargo, el beneficio no se extendió a los recién nacidos con hernia diafragmática congénita. De hecho, hubo una sugerencia de que el outcome fué ligeramente peor en este subgrupo.
Cochrane Database Syst Rev. 2006 Oct 18;(4):CD000399. Nitric oxide for respiratory failure in infants born at or near term. Finer NN, Barrington KJ.
Resultados principales : 14 estudios controlados randomizados en RN a término y casi a término con hipoxia. 7 de los estudios compararon iNO con control en RN con scores de enfermedad grave ó moderada. 4 de los estudios compararon iNO con un control, pero permitieron iniciar el tratamiento con iNO si los recién nacidos mantenían los mismos criterios de gravedad de la enfermedad después de un período de tiempo definido. Dos estudios incluyeron RN con score de gravedad moderada de la enfermedad (IO ó AaDO2) y randomizaron a tratamiento con iNO inmediato ó tratamiento con iNO sólo sí se deterioraban a criterios más severos. Un estudio estudió sólo recién nacidos con hernia diafragmática congénita (Ninos 1997), y un estudio reclutó RN prematuros y a término (Mercier 1998).
El óxido nítrico inhalado parece mejorar el outcome en RN término
y casi término hipoxémicos reduciendo la incidencia de variable
combinada muerte o necesidad de ECMO.
La reducción parece ser enteramente una reducción en la necesidad de
ECMO, la mortalidad no se reduce.
La oxigenación mejora en aproximadamente el 50% de los niños que
recibieron óxido nítrico.
El Índice de Oxigenación disminuye en un promedio (ponderado) de 15,1
dentro de los 30 y 60 minutos después de comenzar la terapia y la PaO2
aumenta en una media de 53 mmHg.
Conclusiones de los revisores:
En base a evidencia actualmente disponible, parece razonable utilizar
óxido nítrico inhalado en una concentración inicial de 20 ppm, para
recién nacidos a término y casi a término con insuficiencia respiratoria
hipóxica que no tienen una hernia diafragmática.
Una dosis de inhalación inicial de 20 ppm se usa comúnmente, aunque una vez establecido, dosis más bajas pueden ser eficaces.
3.- Prostaglandinas
Mientras que
en cierta medida
reemplazada por
iNO en
la unidad neonatal,
la prostaciclina es un
potente
vasodilatador pulmonar,
ya sea administrado por
vía intravenosa o por
inhalación. Como
el mecanismo de acción
se basa en
aumentar
cAMP en
las
células musculares lisas
vasculares, puede tener
un
papel en el tratamiento
de HPP
refractaria a
ONi.
La terapia de combinación
con
ONi
también ha
sido
reportada.
La vasodilatación
e hipotensión sistémica
pueden ser problemáticas,
pero pueden ser mitigadas
por el uso de
inótropos.
La cardiopatía congénita cianótica forma parte del diagnóstico diferencial de la HPPN y si bien ésto puede ser rápidamente resuelto por ecocardiografía, esta modalidad no siempre está inmediatamente disponible. Cuando se sospeche dependencia ductal las prostaglandinas E1 o E2 son rutinariamente infundidas para mantener la permeabilidad ductal.
Además de ser seguras y apropiadas en esta situación, ambos agentes han demostrado tener el beneficio de producir vasodilatación pulmonar, particularmente la prostaglandina E1.
4.- Inhibidores de fosfodiesterasa
Las fosfodiesterasas (PDE) son responsables de la hidrólisis de cGMP a GMP y
la más activa en el músculo liso se piensa que es la PDE5.
Sildenafil y compuestos relacionados son inhibidores selectivos de la PDE5, que está presente en abundancia en los pulmones. Mediante este mecanismo aumenta las concentraciones intracelulares de cGMP en el músculo liso vascular pulmonar y produce vasodilatación pulmonar. Curiosamente, al preservar el aumento de cGMP por el iNO, se ha reportado que los dos agentes trabajan sinérgicamente.26 Se ha demostrado que Sildenafil atenúa la inflamación pulmonar en un modelo de rata de daño pulmonar neonatal hiperóxico.27 Parece ser seguro y aparte de ser una terapia definitiva de HPPN por derecho propio, se ha establecido como un medio para llevar a cabo un retiro de la terapia ONi.28 Debido a la mayor velocidad de acción, su orientación a efectos pulmonares, la no dependencia de la absorción gástrica y a la titulaci{on del ONi, es poco probable que el sildenafil se convierta en su reemplazo como tratamiento inicial, excepto quizás en los países en desarrollo, donde el iNO no está disponible. La dosis óptima de sildenafil por vía oral en RN y lactantes todavía no está del todo clara. El British National Formulary para niños informa dosis iniciales de 0,25 - 0,5 mg / kg / dosis, hasta un máximo de 2 mg/kg/dose.29 Debido a la vida media relativamente, el sildenafil puede darse hasta cada 4 horas, aunque por lo general se administra cada 6-8 horas. También está disponible aunque menos fácilmente, como una preparación intravenosa.
La Milrinona, un inhibidor selectivo de PDE3 en el músculo liso vascular y miocitos cardíacos se ha demostrado que mejora la oxigenación en RN a término con HPPN refractaria a iNO.30 Esta fue una serie de casos limitada y no refleja práctica de rutina. No ocurrió hipotensión sistémica, presumiblemente relacionada con el inotropismo bien documentado de este agente. Vasodilatación pulmonar se ha demostrado en estudios con animales. Por lo general se administra por vía intravenosa, pero también se ha administrado con éxito por inhalación.31 El rango de dosis habitual por infusión intravenosa es 0.3 - 0.7 mcg / kg / min. Las series de HPPN son pequeñas, pero es probable tener más información emergente sobre este tema en un futuro próximo.
5.- Extracorporeal membrane oxygenation
Esta terapia
es una adaptación de
la circulación extracorpórea.
La sangre venosa se
desvía
de las venas
grandes
comúnmente por
canulación de la
vena cava superior
a través de
la vena yugular interna.
Esa sangre
se pasa luego a un
oxigenador de membrana
donde ocurre intercambio gaseoso.
La sangre
se calienta a
la temperatura correcta
y se devuelve
a
la circulación
corporal
del paciente.
Debe tenerse en cuenta
en cualquier
RN a término
con HPPN refractaria a
los tratamientos anteriores.
La
medición más comúnmente utilizada
en evaluación de
si
debe referir
a
ECMO
es el
índice de oxigenación (IO).
OI = (FiO2 x Presión media vía aérea)
PaO2
Donde
FiO2
se expresa como
un porcentaje,
la presión media de
vía aérea en
cm de H2O
y la PaO2
en mm Hg.
ECMO
se debe considerar
si el
IO es
>
40.
Se aplican varios criterios
de exclusión,
siendo el requisito
principal que
la enfermedad
subyacente debe
ser reversible o
corregible,
sin daño
intracraneal ó
coagulopatía significativos
ó anomalía
cromosómica letal.
Los niveles de corte
típicos de edad gestacional y
peso de nacimiento
para
inicio
de esta terapia
son
mayores de 35
semanas y
más de 2
kg,
respectivamente.
Cuatro estudios
de
ECMO
en el tratamiento
de insuficiencia
respiratoria
neonatal fueron
sometidos a
revisión Cochrane
y
todos mostraron
un
fuerte beneficio
en términos de
sobrevida,
sin evidencia de
riesgo aumentado de
discapacidad
severa.32
Dichos estudios
reclutaron grupos
clínicamente similares
con insuficiencia
respiratoria
neonatal debida a
hipertensión pulmonar
persistente y
otras causas,
aunque dos de los
estudios excluyeron a
los recién nacidos con
hernia diafragmática
congénita.
El beneficio
en el subgrupo con
HDC no fué claro.
6.- Sulfato de Magnesio
Sulfato de magnesio
(Mg)
actúa como un
relajante del músculo
liso vascular.
Han habido
varias
series relativamente
pequeñas no randomizadas animales y humanas reportando
utilización
de infusión
intravenosa
de Mg
en
el tratamiento de
hipertensión pulmonar.
Sin embargo, la revisión Cochrane sobre el tema actualizada a fines de 2009 falló en encontrar algún estudio elegible.33 Desde entonces, ha sido publicado recientemente un estudio controlado randomizado de ONi versus Mg en el tratamiento de HPPN en recién nacidos en VAFO.34 Hubo un mejor outcome con ONi.
HP asociada con DBP
Con las mejoras
en la atención
neonatal, hay más
sobrevivientes de
VC ó
VAFO
que continúan
requiriendo
oxígeno suplementario.
El mejor tratamiento de la DBP es la prevención, incluyendo la limitación del daño pulmonar hiperóxico y ventilatorio; la instilación de surfactante, el iNO y el cierre terapéutico del ductus arterioso persistente.
Se requiere una cuidadosa atención a la nutrición y el crecimiento. Se ha demostrado que en los primeros 2 años de vida, el crecimiento pulmonar se produce por un aumento en el número de alvéolos y este proceso puede ser optimizado para generar nuevo parénquima sano. 36
Aunque los datos son limitados y esta terapia no es de uso general, se ha demostrado que la suplementación con vitamina A reduce la incidencia de DBP en prematuros.37
Las infecciones intercurrentes aumentarán los requerimientos de oxígeno y pueden dañar adicionalmente al pulmón y deben ser tratadas con eficacia.
Específicamente, la infección neonatal con Ureaplasma urealyticum se asocia con mayores tasas de DBP.38 Sin embargo, la opinión sigue dividida en cuanto a si la relación es causal, y el más reciente estudio controlado y randomizado (RCT) ha fallado en demostrar beneficio concluyente de la terapia con azitromicina en la prevención de la DBP en el pretérmino.39
Anatomopatológicamente, el trastorno se caracteriza por la apariencia de simplificación alveolar y morfología capilar anormal, con variable proliferación celular intersticial y fibroproliferación. Se ha demostrado una reducción en el número y tamaño de arterias pulmonares intra-acinares en recién nacidos con DBP.10 Esta contracción del lecho vascular pulmonar sóla , o en combinación con muscularización arterial pulmonar anormal puede causar RVP aumentada e HP consecuente.
Aunque el rol de la inflamación pulmonar en la DBP ha sido ampliamente reconocido, el beneficio del tratamiento con esteroides no se ha encontrado que concluyentemente compense los riesgos. 40
Manejo de HP en DBP
Por definición,
la DBP implica la
necesidad persistente
de oxígeno,
pero el umbral para
definir
esta necesidad
varía entre
las unidades de neonatología.
El papel de la vasoconstricción pulmonar hipóxica debe ser reconocido y balanceado con el riesgo de toxicidad de los radicales libres de oxígeno y la inconveniencia de suplemento de oxígeno, sobre todo en forma ambulatoria. Si bien existe una falta de evidencia base para la elección de la saturación de oxígeno en el RN convalesciente DBP, hay preocupaciones legítimas que la hipoxemia relativa puede exacerbar la hipertensión pulmonar.
En la práctica,
muchas unidades
defienden
el mantenimiento de
saturaciones de oxígeno
en los bajos 90
ó incluso en los altos 80.
Cuando
la DBP e HP
estén
documentadas como severas,
saturaciones más
"normales" (≥
95%) pueden estar indicadas.
En modelos animales de displasia broncopulmonar, se ha demostrado que el sildenafil beneficia el crecimiento alveolar, la angiogénesis pulmonar y la sobrevida y reduce la inflamación pulmonar, además de los efectos bien documentados sobre RVP. Una serie retrospectiva recientemente publicada de 25 pacientes con DBP , menores de 2 años mostró una mejoría hemodinámica en 88%, con efectos adversos en dos pacientes.41
Como nota de precaución, el mecanismo protector de la vasoconstricción pulmonar hipóxica puede ser anulada por el uso de vasodilatadores pulmonares orales (figura 2). Mientras que el ONi tiene el potencial para adaptar mejor la perfusión a la ventilación pulmonar, los vasodilatadores pulmonares orales tienen un efecto específico menor y no vasodilatan preferentemente las áreas mejor ventiladas del pulmón. De esta manera, la alteración de la relación ventilación-perfusión puede ser exacerbada, resultando en el deterioro de saturaciones de oxígeno.
HP asociada con
cardiopatía congénita
La incidencia en el Reino Unido de cardiopatías congénitas es de alrededor de 8 por 1.000 nacidos vivos. En la mayoría de estos casos las lesiones son relativamente simples, tales como defectos de pequeño a moderado tamaño de los septums ó estenosis valvulares leves. El ductus arteriaso está normalmente presente en el recién nacido, pero por lo general se cierra dentro de los primeros de vida en los RNT a término, sanos. Debido a la relativamente alta RVP en el período de recién nacido muchas de estas lesiones no se diagnostican hasta más tarde en la vida.
Lesiones cardíacas específicas en la siguientes categorías forman parte del diagnóstico diferencial de HPPN y deben ser identificadas :
Circulación pulmonar dependiente de ductus , por ejemplo, atresia pulmonar
Circulación sistémica dependiente de ductus , por ejemplo, sindrome de corazón izquierdo hipoplásico
Transposición de las grandes arterias
Drenaje venoso pulmonar anómalo total
Malformación de Ebstein de la válvula trcúspide (casos graves)
Resumen
La
mayoría de los casos
de hipertensión pulmonar
neonatal
implican
un diagnóstico de
hipertensión pulmonar
persistente neonatal ó DBP.
La cardiopatía congénita cianótica es parte del diagnóstico diferencial de HPPN y debe ser activamente descartada, sobre todo en los casos refractarios a los regímenes de tratamiento inicial.
Es raro que una lesión cardíaca sea primariamente responsable de hipertensión pulmonar neonatal aunque la estenosis de vena pulmonar y la persistencia de ductus arterioso deben ser considerados, especialmente en el prematuro de mayor edad con displasia broncopulmonar.
FIN