Reporte de caso zona umbral de viabilidad
Febrero 2021
Reporte de caso :
Sobrevida intacta de prematuro varón zona umbral de viabilidad
nacido con Peso 268 gramos a 24 semanas de gestación.
Arimitsu T, Wakabayashi D,
Tamaoka S, Takahashi M, Hida M and Takahashi T
Department of Pediatrics, Keio
University School of Medicine, Tokyo, Japan
Frontiers in Pediatrics | www.frontiersin.org
1 February 2021 | Volume 8 | Article 628362
Los autores reportan el caso
de un prematuro varón pequeño para edad gestacional nacido a las 24
semanas de gestación con peso al nacer de 268 g que fue dado de alta
del hospital de los autores sin requerimiento de oxigenoterapia ni
alimentación por sonda domiciliarios. No presentó hemorragia
intraventricular grave, leucomalacia periventricular, discapacidad
auditiva ni ninguna otra complicación mayor. En ese momento (febrero
de 2019), según el Registro de bebés más pequeños de la Universidad
de Iowa, era el bebé varón más pequeño del mundo en sobrevivir sin
complicaciones graves, aparte de la retinopatía grave del prematuro
que requerió terapia con láser. Aunque la tasa de sobrevida de
prematuros con peso extremadamente bajo al nacer está mejorando en
todo el mundo, una alta tasa de mortalidad e incidencia de
complicaciones graves siguen siendo comunes para los prematuros que
pesan < 300 g al nacer, sobre todo en varones.
En los últimos años, ha habido discusiones frecuentes sobre los
problemas éticos y sociales involucrados en el tratamiento de
prematuros extremos que pesan < 400 g. A pesar de los desafíos,
están aumentando los reportes sobre la sobrevida de estos niños. La
medicina neonatal ya ha logrado un gran éxito en tratar bebés que
pesan 400 g o más al nacer. Sin embargo, la falta de evidencia y
experiencia puede hacer que los médicos se muestren reacios a tratar
a prematuros que pesen menos de ésto.
El presente caso demuestra que la sobrevida intacta de un prematuro en zona umbral de viabilidad con peso al nacer < 300 g es posible con manipulación mínima y atención centrada en la familia iniciada poco después del nacimiento. La descripción detallada del curso clínico de este caso debería proporcionar información invaluable a los médicos de todo el mundo que tratan a estos niños. Este reporte ayudará en el progreso de la medicina neonatal y ayudará a abordar muchos de los problemas sociales y éticos que rodean su cuidado.
Keywords: intact survival, extremely low birth weight, male, birth weight of 268 g, marginally viable infant, minimal handling, family involvement
Introducción
Los reportes detallados de casos de prematuros con peso al nacer < 300 g son extremadamente limitados debido a su tasa de sobrevida extremadamente baja (1-9). En particular, los outcomes clínicos son extremadamente desfavorables para los prematuros varones en esta categoría (1, 3, 10, 11). Desde febrero de 2019, solo 23 prematuros con peso < 300 g al nacer estaban registrados en el Registro de prematuros más pequeños de la Universidad de Iowa (University of Iowa’s Tiniest Babies Registry) , de los cuales solo cuatro eran varones (12). Sin embargo, un reporte sobre alta exitosa de un prematuro nacido en 1938 con peso al nacer de 283 g indica que algunos de esos niños son viables con tratamiento adecuado (12). La mejora continua en todo el mundo en la tasa de sobrevida de prematuros con extremo bajo peso al nacer puede atribuirse a la acumulación de experiencia y evidencia de los clínicos a lo largo de los años. La acumulación continua de reportes de casos es esencial para mejorar los outcomes clínicos de algunos de estos niños.
La medicina neonatal ya ha logrado un gran éxito en el cuidado de
bebés que pesan 400 go más al nacer (1, 3) .Sin embargo, los médicos
pueden dudar en tratar a prematuros que nacen con un peso menor, en
particular los que pesan menos de 300 g, debido al pronóstico
desfavorable y la falta de de la práctica basada en la evidencia. En
el caso de prematuros varones en particular, la alta tasa de
mortalidad y la incidencia de complicaciones graves siguen siendo
problemas sin resolver (10, 11). Sin embargo, ha habido varios
reportes recientes de sobrevida de prematuros que pesan < 300 g al
nacer (1, 8, 9). Actualmente existe una discusión activa sobre el
enfoque ético y social apropiado para tratar a los prematuros de
extremo bajo peso al nacer.
Los autores presentan el caso de un prematuro pequeño para edad gestacional que nació a las 24 semanas de gestación con peso al nacer de 268 g y fue dado de alta del hospital de los autores sin requerir oxigenoterapia ni alimentación por sonda domiciliarios. No presentó hemorragia intraventricular grave, leucomalacia periventricular, discapacidad auditiva ni ninguna otra complicación grave. Este caso ilustra la importancia tanto de la manipulación mínima y del cuidado centrado en la Familia.
El concepto de manipulación mínima ha sido familiar para los pediatras desde 1980 (13-18). Hoy en día, esto se ha convertido en un estándar de cuidado, especialmente en prematuros, dado que promueve la estabilidad cardiopulmonar y se asocia con buenos outcomes a largo plazo. Sin embargo, no está claro hasta qué punto se pueden mantener los estándares mínimos de manipulación con los prematuros en zona umbral de viabilidad , ya que la manipulación puede ser necesaria para la evaluación y tratamiento. Además, la evidencia sobre la aplicación de manipulación mínima en estos prematuros es limitada, ya que hay pocos reportes sobre sobrevivientes en esta población y los que existen han involucrado generalmente a prematuros que pesan más de 300 g al nacer. Por lo tanto, el reporte de los autores proporciona información sobre la aplicación de estándares mínimos de manipulación para prematuros en zona umbral de viabilidad.
El cuidado centrado en la familia es el estándar de cuidado para
prematuros ingresados a la Unidad de Cuidados Intensivos
Neonatales (UCIN) y puede considerarse como la base de apoyo
esencial del tratamiento de la UCIN. Fortalece los vínculos entre
los miembros de la familia, reduce el estrés tanto para los bebés
como para sus familias y promueve la estabilidad y el desarrollo
infantil (19-21). A pesar de estos beneficios, el personal del
hospital a menudo duda en involucrar a la familia en el cuidado de
prematuros en zona umbral de viabilidad debido al riesgo de
infección e inestabilidad de los prematuros y hay pocos reportes
sobre los efectos de la participación familiar en estos bebés. Los
autores consideran que la participación familiar es especialmente
importante en estos casos porque el estrés que sufren las familias
es extraordinario. Los autores esperan que su reporte sobre la
participación exitosa de la familia en el tratamiento de un
prematuro vulnerable anime al personal del hospital a aumentar la
participación de la familia en estos casos
Descripción del Caso
Bebé varón nacido
de madre de 30 años sin antecedentes clínicos significativos
(G0P0A0) que quedó embarazada por inseminación natural. A las 23
semanas de gestación, la madre fue referida al hospital de los
autores debido a severa restricción del crecimiento fetal provocada
por insuficiencia útero - placentaria y fue tratada con esteroides
prenatales. La madurez fetal se determinó mediante el cálculo del
último período menstrual de la madre y se confirmó mediante
ecografía prenatal. Se realizó consejería prenatal a los padres,
quienes solicitaron parto por cesárea. A las 24 semanas y 0 días
de gestación, el bebé nació mediante cesárea de emergencia debido a
la interrupción del flujo sanguíneo en cordón umbilical; no hubo
enrollamiento del cordón umbilical ni tinción de líquido amniótico.
El peso de la placenta fue 60 g. El examen anátomo - patológico
placentario reveló infarto. No se observaron hallazgos de
corioamnionitis. Inmediatamente después del nacimiento, fué
envuelto con una bolsa de plástico y colocado bajo calentador
radiante precalentado. La temperatura ambiente del quirófano se fijó
en 27 ° C (22). Fue intubado en quirófano con tubo endotraqueal de 2
mm y trasladado a UCIN en incubadora. La temperatura axilar al
ingreso fué 35,8 ° C. La humedad en la incubadora se fijó en 90% el
día 0 para reducir la pérdida de agua insensible y se disminuyó en
5% diario hasta 60% (23). Su score de Apgar fue 2 al minuto 1
después del nacimiento, 6 a los 5 minutos y 6 a los 10 minutos.
Aparte de su tamaño, su examen físico y los resultados de las pruebas de laboratorio no fueron destacables. La evaluación de la maduración posnatal fue adecuada para un bebé prematuro nacido a las 24 semanas de gestación. Se descartaron trastornos genéticos como causa de restricción del crecimiento intrauterino según los hallazgos del examen físico y la ecografía y los resultados de exámenes de sangre, incluyendo gases en sangre, hemograma completo y bioquímica. Por lo tanto, no se realizaron pruebas genéticas. Su peso al nacer fue de 268 g (−3,92 DE). Para priorizar la estabilización, no se midieron la talla ni la circunferencia craneana al nacer las que fueron medidas por primera vez el día 16 posnatal (edad posmenstrual 26 semanas, 2 días), su circunferencia cefálica fué 18.5 cm (−3,03 DE) y su talla 24.0 cm (−3,7 DE).
A su ingreso a UCIN, se colocó
en ventilación oscilatoria de alta frecuencia por baja compliance
pulmonar y se le administró surfactante los días 0 y 2. No se
realizó sedación. Se inició cafeína anhidra se inició desde el día
0. Se administraron antibióticos profilácticos (ampicilina,
gentamicina y fosfluconazol) después del nacimiento y se continuaron
hasta el día 6. Debido a que la arteria umbilical era estrecha, no
se pudo insertar un catéter en arteria umbilical.
La presión arterial del prematuro se midió después del nacimiento mediante un catéter arterial periférico de 24 G para evitar el riesgo de daño que supondría un manguito (cuff) para su piel inmadura y tenía el valor aproximado esperado para su edad gestacional; por tanto, no se administraron inótropos. Después de la oclusión del catéter el día 8, se evaluó su presión arterial principalmente mediante examen físico. Los rangos target (objetivo) de agentes osmóticos se establecieron con referencia a estudios previos, y su nivel de albúmina se mantuvo por encima de 2,5 g / dl para mantener presión osmótica (24-27).
Se realizó Ecocardiografía para diagnosticar ductus arteriodo persistente (DAP) el día 1. Se administró 0,1 mg / kg por dosis de indometacina, porque la ecocardiografía mostró shunt aumentado de volumen del DAP (28, 29). El DAP cerró tras la administración de indometacina el día 1. Requirió 45 días de ventilación mecánica, incluídos 40 días de ventilación oscilatoria de alta frecuencia (Figura 1). Fué extubado el día 45 (30 semanas y 3 días de edad posmenstrual) cuando se confirmó que cánulas de CPAP se ajustaban a su nariz.
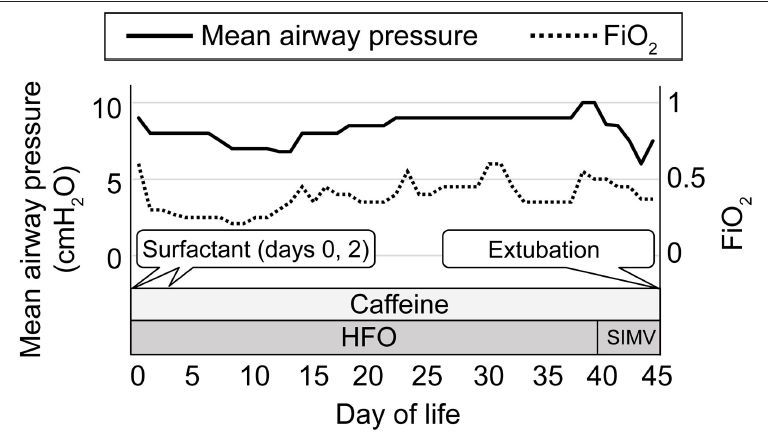
Figura 1.- Evolución clínica del manejo respiratorio. El eje vertical izquierdo indica el parámetro máximo diario del ventilador para presión media de vía aérea y el eje vertical derecho indica el parámetro máximo diario del ventilador para FiO2. El eje horizontal indica el día de vida posnatal. La línea continua indica la presión media de vía aérea y la línea de puntos indica FiO2. HFO, oscilación de alta frecuencia; SIMV, ventilación mandatoria intermitente sincronizada.
Su peso corporal cuando se
midió después de extubación fué 518 g el día 51 (31 semanas y 2 días
del día posmenstrual). A partir del día 42, recibió un esteroide
sistémico (dexametasona) durante 10 días, según lo aconsejado por
Doyle et al. (30). Después de una extubación exitosa, requirió
CPAP durante 7 días y Cánula nasal de alto flujo durante 116 días. La SpO2
target se
estableció en 85-95% antes de 34 semanas de edad posmenstrual y
por encima del 95% después.
Se inició nutrición parenteral el día 0 mediante un catéter venoso umbilical de 18 G. Después de que este catéter se ocluyó el día 12, se utilizó un catéter venoso central de inserción periférica de 27 G, pero también se ocluyó el día 19. A partir de entonces, se continuó la nutrición parenteral a través de un catéter venoso periférico. El día 1, los padres realizaron la administración oral de leche materna usando un hisopo de algodón y se inició la alimentación trófica por sonda nasogástrica. Se administró por vía rectal un máximo de 3 ml / kg de ácido amidotrizoico diluido 5 veces durante 1 semana a partir del día 1, lo que causó defecación exitosa.
Después de 3 días de alimentación trófica, se interrumpió la alimentación enteral debido a que el abdomen del bebé se estaba dilatando gradualmente. Su radiografía de abdomen diaria indicó una expansión significativa de gases intestinales y se le diagnosticó íleo meconial . La administración intragástrica de 3 ml / kg de ácido amidotrizoico diluido 5 veces logró eliminación masiva de deposiciones, como se describe en estudios previos (31-35). Posteriormente, mejoró la distensión abdominal y se reanudó la alimentación enteral.
Se utilizó leche materna fortificada a partir del día 20, cuando el consumo de leche materna del prematuro alcanzó 100 ml / kg por día. Se mantuvo con leche materna durante la mayor parte de su estadía en el hospital, agregando aceite de triglicéridos de cadena media desde el día 94 al 133 para aumento de calorías. El objetivo de calorías se fijó en 120-140 kcal / kg / día.
La alimentación oral se inició
el día 98 y la sonda gástrica se retiró el día 137. Durante el
tratamiento, la glicemia se manejó dentro del rango de
referencia con administración de glucosa y alimentación enteral
únicamente, excepto la administración de insulina el día 1 y
del día 5 al 6. El aporte de líquidos se determinó a partir de los
signos vitales y los hallazgos físicos, balance hídrico y
resultados de los análisis de sangre. El aporte de líquidos estaba
relativamente restringido con la expectativa de reducir el riesgo de
morbilidad y complicaciones (36). La pérdida de agua transepidérmica
se estimó en función de los niveles de sodio, aporte hídrico,
diuresis y reportes previos (37). El
volumen total de líquido administrado el día 0 fue 65 ml / kg;
durante la mayor parte del período posterior a la estabilización del
paciente, se mantuvo entre 130 y 160 ml / kg por día. La
manipulación mínima se llevó a cabo en todos los aspectos del manejo
del paciente. Como se describió anteriormente, las mediciones
antropométricas se mantuvieron al mínimo, y el peso del
paciente se estimó a partir del balance nutricional y de líquidos
y se ajustó el día en que se midió.
Después de su primer pesaje el día 0, no se volvió a pesar hasta el día 30 para confirmar el crecimiento esperado. Su peso corporal, talla y circunferencia cefálica se midieron cada 2 semanas después de eso. Hasta el día 42 se mantuvo al prematuro en decúbito prono sin cambio postural, con el objetivo de prevenir tanto el reflujo gastroesofágico como la extubación no planificada. Durante ese período, se realizó un cuidadoso manejo de la piel, asegurando brindarle el apoyo adecuado para prevenir las úlceras por presión.
Aunque minimizar el cambio postural puede incrementar el riesgo de infección cutánea y pulmonar, solo hubo dos eventos después del día del nacimiento en los que se debió administrar antibióticos : del día 38 al 45 por sospecha de neumonía por aspiración y del día 66 al 76 por celulitis debida a Estafilococo aureus sensible a Meticilina en el sitio del catéter periférico removido.
También se minimizó la toma de muestras de sangre para reducir la frecuencia de procedimientos dolorosos y el riesgo de anemia iatrogénica. Durante un mes después del nacimiento, se realizaron punciones en talón tan solo una vez al día para analizar gases en sangre, electrolitos, factores metabólicos (glucosa, lactato) y factores bioquímicos (albúmina, fosfato, proteína C reactiva). se realizó examen de sangre completo (hemograma completo y pruebas bioquímicas) solo una vez cada 1 o cada 2 semanas (Tabla 1).
Tabla 1.- Número promedio de punciones de talón y aspiraciones endotraqueales diarias para pacientes de la UCIN durante las primeras 2 semanas de vida.
|
Fuente |
Punciones de talón |
Aspiraciones endotraqueales |
|
Simons et al. (38) |
1 |
3.3 |
|
Carbajal et al. (39) |
3.2 |
3.7 |
|
Cignacco et al. (40) |
1.2 |
1.9 |
|
Jeong et al. (41) |
1 |
1.6 |
|
Guedj et al. (42) |
1.4 |
2.4 |
|
Britto et al. (43) |
2.4 |
0.5 |
|
Roofthooft et al. (44) |
1 |
3.3 |
|
Caso actual |
3 |
4.7 |
|
Se calculó el número promedio de procedimientos diarios por paciente en UCIN |
||
Además de manipulación mínimo,
alentamos la participación de los padres desde el día del
nacimiento. Poco después de que naciera el bebé, la familia comenzó
a hablarle y abrazarlo. Los padres visitaban con frecuencia nuestra UCIN para tener contacto físico con él, incluyendo lactancia
materna , que
se realizó desde el día 1 (Video complementario 1).
La resonancia magnética de la cabeza a las 45 semanas de edad posmenstrual no reveló anomalías detectables. Se realizó prueba de respuesta auditiva del tronco encefálico automatizada que fué normal bilateral. Sin embargo, el niño desarrolló retinopatía bilateral del prematuro (etapas 2 - 3), que requirió tratamiento con láser. Fue dado de alta del hospital el día 176 (edad corregida 49 semanas y 1 día) sin requerimiento de oxigenoterapia o de sonda de alimentación domiciliarios.
Su peso corporal al alta fué 3.238 g (−3.41 DE), su CC 35.5 cm (−1.31 DE) y su Talla 46.8 cm (−4.55 DE) (Figura 2) (45). La madre del paciente dijo que solo podía decir lo feliz que estaba de que él hubiera crecido tanto.
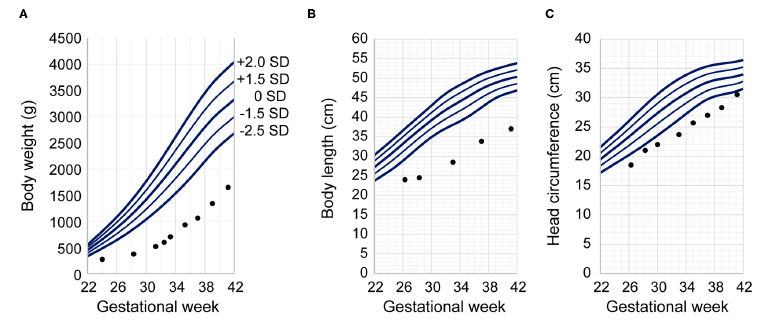
Figura 2.- Tablas de crecimiento del paciente. Las medidas antropométricas del prematuro de este caso se grafican contra gráficos antropométricos neonatales japoneses de bebés varones nacidos de una madre primigesta según edad gestacional al nacer. Los puntos indican las medidas del paciente a la edad posmenstrual determinada. Los ejes verticales indican (A) peso corporal, (B) talla y (C) circunferencia cefálica. El eje horizontal indica edad gestacional para las tablas antropométricas neonatales japonesas y la edad posmenstrual para nuestra paciente. Los gráficos antropométricos neonatales japoneses presentan cinco líneas continuas que indican la distribución de los datos; En orden de arriba hacia abajo, representan la media +2.0 DE, +1.5 DE, ± 0 DE, -1.5 DE y -2.0 DE.
Discusión
Aunque la medicina neonatal ha avanzado lo suficiente como para producir outcomes clínicos favorables para la mayoría de los bebés prematuros, los médicos aún dudan en tratar a los que pesan <300 g al nacer, especialmente a los bebés varones, debido a la falta de experiencia y evidencia (1-12). Reportes de casos de bebés varones que pesan < 300 g al nacer son especialmente raros debido a una tasa de sobrevida mucho más baja que la de las niñas de peso similar.
El presente reporte de
caso relata la evolución clínica detallada de un prematuro pequeño para
edad gestacional que pesó 268 g a las 24 semanas de gestación;
siendo en
febrero de 2019 el bebé varón más pequeño del mundo en ser dado
de alta del hospital sin ninguna complicación grave aparte de la
retinopatía grave del prematuro que requirió terapia con láser (12,
46).
El tratamiento con esteroides antenatales contribuyó en gran medida a la ausencia de complicaciones graves en el presente caso (47). La ausencia de rotura prematura de membranas antes del parto, que causa corioamnionitis y oligohidramnios, también fue beneficiosa para la sobrevida del prematuro (48, 49). Aunque el peso corporal al nacer del presente caso fue extremadamente bajo, el curso clínico exitoso también se relacionó con el hecho de que el niño nació a las 24 semanas de gestación debido a una restricción del crecimiento intrauterino en lugar de las 22 o 23 semanas de gestación (50). . Es probable que la causa principal de la retinopatía grave del prematuro sea la corta edad gestacional y el peso extremadamente bajo al nacer (38, 39). La displasia broncopulmonar también podría aumentar su riesgo (40). Se necesitan más investigaciones para mejorar los outcomes para los bebés en umbral de viabilidad.
La Tabla 1 muestra que el
número de punciones de talón y aspiraciones endotraqueales durante
las 2 primeras semanas de vida en el presente caso es similar al
reportado en casos anteriores (41-4, 51-53). Durante este período,
nuestro paciente se sometió a tres punciones en talón (rango 1-5)
y 4.7 aspiraciones endotraqueales (rango 1-9) por día en promedio;
algunos días, recibió tan solo 1 de cada una. Sorprendentemente,
estos números fueron similares a los reportados en casos anteriores
que involucraban a bebés con peso al nacer de más de 300 g. Si la
manipulación se puede minimizar de forma segura, ésto puede mejorar
la estabilidad del paciente y promover el desarrollo (13-18). Sin
embargo, el médico debe determinar el grado necesario de
manipulación, ya que una manipulación mínima también significa menos
información sobre la situación del paciente. Afortunadamente,
el hospital de los autores tiene experiencia previa con
prematuros con peso
al nacer < 300 g (8), lo que ayudó a minimizar el manejo en el
presente caso.
Con respecto a la participación de la familia durante la fase aguda del tratamiento, las preocupaciones sobre infección e inestabilidad pueden llevar a algunos clínicos a abstenerse de alentar a las familias a buscar de manera proactiva el contacto con sus bebés. Sin embargo, los autores creen que alentar a las familias a que carguen a sus bebés y hablen con ellos contribuye a la estabilidad del prematuro y mejora el desarrollo a largo plazo (19-21). El presente caso demuestra que la participación familiar que comienza poco después del nacimiento se puede lograr de manera segura y puede afectar positivamente el bienestar emocional de la familia y los outcomes o resultados clínicos del bebé.
Una limitación de este reporte
es que no está claro el número de prematuros con peso < 300 g al
nacer que podrían sobrevivir. La base de datos mundial de la
Universidad de Iowa de bebés sobrevivientes con peso al nacer < 400 g
incluye casos reportados en medios de comunicación y revistas
médicas, así como reportes enviados directamente por médicos, pero
es posible que algunos de esos casos no estén incluidos (12) . Sin
embargo, la base de datos mencionada anteriormente es actualmente la
base de datos más grande de prematuros en zona umbral de viabilidad sobrevivientes
en todo el mundo. Dadas las bajas tasas de
sobrevida informadas en la literatura, es probable que el número
real de sobrevivientes en esta población sea extremadamente bajo
(1–11).
La experiencia de los autores , en este caso, demuestra que una manipulación mínima puede ser segura y eficaz en el tratamiento de bebés con peso al nacer < 300 g y que la interacción con la familia que comienza poco después del nacimiento puede afectar positivamente los outcomes clínicos y las relaciones familiares sin efectos adversos.
Los autores concluyen que se pueden lograr mejores resultados clínicos y relaciones familiares sólidas para los prematuros en zona umbral de viabilidad mediante la consideración meticulosa de la manipulación mínima y la participación familiar junto con la aplicación de investigación actualizada y dispositivos médicos avanzados. Este reporte describe un caso muy raro que podría ser una fuente de información invaluable para el desarrollo de la medicina neonatal. Se requieren más desarrollos de investigación.
Etica
No se requirió una revisión y
aprobación éticas para el estudio en participantes humanos de
acuerdo con la legislación local y los requisitos institucionales.
Los pacientes / participantes proporcionaron su consentimiento
informado por escrito para participar en este estudio. Se obtuvo el
consentimiento escrito informado de los padres de los
participantes para la publicación de este reporte de caso y
cualquier información o imagen identificable.
Contribuciones de los autores
TA fue un médico tratante del
paciente, realizó la revisión de la literatura y redactó el primer
borrador del manuscrito. DW, ST y MT ayudaron en el tratamiento del
paciente. MH y TT supervisaron el tratamiento del paciente,
proporcionaron contribuciones científicas y revisaron críticamente
el artículo. Todos los autores leyeron y aprobaron la versión final
del manuscrito.
Agradecimientos
Agradecemos a todo el personal de la División de Neonatología del Hospital de la Universidad de Keio, especialmente al Dr. Kaori Hara, Dr Takane Kin, Dr . Masayoshi Shinjoh y Dr. Norihiro Nagai, por su ayuda en el tratamiento del paciente; Satoru Ikenoue y Miho Kawaida por sus consejos sobre el manuscrito; y al Dr. Taisuke Nogayama por su ayuda en la descripción de las tablas de crecimiento. También agradecemos al bebé y a sus padres por sus contribuciones.
Material suplementario
El material suplementario para este artículo puede ser encontrado online en : https://www.frontiersin.org/articles/10.3389/fped.2020.628362/full#supplementary-material
Referencias
-
Inoue H, Ochiai M, Yasuoka K, Tanaka K, Kurata H, Fujiyoshi J, et al. Early mortality and morbidity in infants with birth weight of 500 grams or less in Japan. J Pediatr. (2017) 190:112–7.e3. doi: 10.1016/j.jpeds.2017.05.017
-
Lau C, Ambalavanan N, Chakraborty H, Wingate MS, Carlo WA. Extremely low birth weight and infant mortality rates in the United States. Pediatrics. (2013) 131:855–60. doi: 10.1542/peds.2012-2471
-
Brumbaugh JE, Hansen NI, Bell EF, Sridhar A, Carlo WA, Hintz SR, et al. Outcomes of extremely preterm infants with birth weight <400 g. JAMA Pediatr. (2019) 173:434–45. doi: 10.1001/jamapediatrics.2019.0180
-
Nishida H, Sakuma I. Limit of viability in Japan: ethical consideration. J Perinat Med. (2009) 37:457–60. doi: 10.1515/JPM.2009.112
-
Muraskas J, Hasson A, Besinger RE. A girl with a birth weight of 280 g, now 14 years old. N Engl J Med. (2004) 351:836– 7. doi: 10.1056/NEJM200408193510826
-
Muraskas JK, Carlson NJ, Halsey C, Frederiksen MC, Sabbagha RE. Survival of a 280-g infant. N Engl J Med. (1991) 324:1598–
9. doi: 10.1056/NEJM199105303242213 -
Muraskas JK, Rau BJ, Castillo PR, Gianopoulos J, Boyd LA. Long-term followup of 2 newborns with a combined birth weight of 540 grams. Pediatrics.
(2012) 129:e174–8. doi: 10.1542/peds.2010-0039 -
Hokuto I, Ikeda K, Tokieda K,Mori K, Sueoka K. An ultra-premature baby of 290 g birth weight needed more than 500 mg/kg of calcium and phosphorus daily. Eur J Pediatr. (2001) 160:450–1. doi: 10.1007/s004310100761
-
Kohelet D, Arbel E, Shochat R, Tavori I. Survival of a 300-g infant ventilated by high-frequency oscillatory ventilation for respiratory distress syndrome. Crit Care Med. (2002) 30:1152–5. doi: 10.1097/00003246-200205000-00033
-
Garfinkle J, Yoon EW, Alvaro R, Nwaesei C, Claveau M, Lee SK, et al. Trends in sex-specific differences in outcomes in extreme preterms: progress or natural barriers? Arch Dis Child Fetal Neonatal Ed. (2020) 105:158– 63. doi: 10.1136/archdischild-2018-316399
-
Kent AL, Wright IM, Abdel-Latif ME, New South W, Australian Capital Territory Neonatal Intensive Care Units Audit G. Mortality and adverse neurologic outcomes are greater in preterm male infants. Pediatrics. (2012) 129:124–31. doi: 10.1542/peds.2011-1578
-
The University of Iowa. The Tiniest BabiesTM. (2019). Available online at: https://webapps1.healthcare.uiowa.edu/TiniestBabies/index.aspx
-
Speidel BD. Adverse effects of routine procedures on preterm infants. Lancet. (1978) 1:864–6. doi: 10.1016/S0140-6736(78)90204-0
-
Murdoch DR, Darlow BA. Handling during neonatal intensive care. Arch Dis Child. (1984) 59:957–61. doi: 10.1136/adc.59.10.957
-
Danford DA, Miske S, Headley J, Nelson RM. Effects of routine care procedures on transcutaneous oxygen in neonates: a quantitative approach. Arch Dis Child. (1983) 58:20–3. doi: 10.1136/adc.58.1.20
-
Long JG, Philip AG, Lucey JF. Excessive handling as a cause of hypoxemia. Pediatrics. (1980) 65:203–7. doi: 10.1542/peds.65.2.203
-
Dahl M, Kamper J. Physical outcome and school performance of verylow- birthweight infants treated with minimal handling and early nasal CPAP. Acta Paediatr. (2006) 95:1099–103. doi: 10.1080/08035250600609781
-
Latini G, De Felice C, Presta G, Rosati E, Vacca P. Minimal handling and bronchopulmonary dysplasia in extremely low-birth-weight infants. Eur J Pediatr. (2003) 162:227–9. doi: 10.1007/s00431-002-1131-5
-
Lv B, Gao XR, Sun J, Li TT, Liu ZY, Zhu LH, et al. Family-centered care improves clinical outcomes of very-low-birth-weight infants: a quasiexperimental
study. Front Pediatr. (2019) 7:138. doi: 10.3389/fped.2019.00138 -
Raiskila S, Axelin A, Toome L, Caballero S, Tandberg BS, Montirosso R, et al. Parents’ presence and parent-infant closeness in 11 neonatal intensive care units in six European countries vary between and within the countries. Acta Paediatr. (2017) 106:878–88. doi: 10.1111/apa.13798
-
Pineda R, Bender J, Hall B, Shabosky L, Annecca A, Smith J. Parent participation in the neonatal intensive care unit: predictors and relationships to neurobehavior and developmental outcomes. Early Hum Dev. (2018) 117:32–8. doi: 10.1016/j.earlhumdev.2017.12.008
-
McCall EM, Alderdice F, Halliday HL, Vohra S, Johnston L. Interventions to prevent hypothermia at birth in preterm and/or low birth weight infants. Cochrane Database Syst Rev. (2018) 2:CD004210. doi: 10.1002/14651858.CD004210.pub5
-
Glass L, Valdez A. Preterm infant incubator humidity levels: a systematic review. Adv Neonatal Care. (2020). doi: 10.1097/ANC.0000000000000791.
-
Yang CY, Li BY, Xu P, Yang YJ, Yang QZ. Correlation of serum albumin with the clinical features and prognosis of preterm neonates in the neonatal intensive care unit. Clin Exp Obstet Gynecol. (2016) 43:149–53.
-
Torer B, Hanta D, Yapakci E, Gokmen Z, Parlakgumus A, Gulcan H, et al. Association of serum albumin level and mortality in premature infants. J Clin Lab Anal. (2016) 30:867–72. doi: 10.1002/jcla.21949
-
Arsenault D, Brenn M, Kim S, Gura K, Compher C, Simpser E, et al. A.S.P.E.N. Clinical Guidelines: hyperglycemia and hypoglycemia in the neonate receiving parenteral nutrition. JPEN J Parenter Enteral Nutr. (2012) 36:81–95. doi: 10.1177/0148607111418980
-
Späth C, Sjöström ES, Ahlsson F, Ågren J, Domellöf M. Sodium supply influences plasma sodium concentration and the risks of hyper- and hyponatremia in extremely preterm infants. Pediatr Res. (2017) 81:455– 60. doi: 10.1038/pr.2016.264
-
Carmo KB, Evans N, Paradisis M. Duration of indomethacin treatment of the preterm patent ductus arteriosus as directed by echocardiography. J Pediatr.
(2009) 155:819–22.e1. doi: 10.1016/j.jpeds.2009.06.013 -
Singh Y, Fraisse A, Erdeve O, Atasay B. Echocardiographic diagnosis and hemodynamic evaluation of patent ductus arteriosus in extremely low gestational age newborn (ELGAN) infants. Front Pediatr. (2020) 8:573627. doi: 10.3389/fped.2020.573627
-
Doyle LW, Davis PG, Morley CJ, McPhee A, Carlin JB. Low-dose dexamethasone facilitates extubation among chronically ventilator-dependent
infants: a multicenter, international, randomized, controlled trial. Pediatrics. (2006) 117:75–83. doi: 10.1542/peds.2004-2843 -
Kubota A, Imura K, Yagi M, Kawahara H, Mushiake S, Nakayama M, et al. Functional ileus in neonates: Hirschsprung’s disease-allied disorders vs. meconium-related ileus. Eur J Pediatr Surg. (1999) 9:392– 5. doi: 10.1055/s-2008-1072290
-
Kubota A, Shiraishi J, Kawahara H, Okuyama H, Yoneda A, Nakai H, et al. Meconium-related ileus in extremely low-birthweight neonates: etiological
considerations from histology and radiology. Pediatr Int. (2011) 53:887– 91. doi: 10.1111/j.1442-200X.2011.03381.x -
Michikata K, Kodama Y, Kaneko M, Sameshima H, Ikenoue T, Machigashira S, et al. Oral diatrizoate acid for meconium-related ileus in extremely preterm
infants. Pediatr Int. (2018) 60:714–8. doi: 10.1111/ped.13606 -
Haiden N, Norooz F, Klebermass-Schrehof K, Horak AS, Jilma B, Berger A, et al. The effect of an osmotic contrast agent on complete meconium evacuation in preterm infants. Pediatrics. (2012) 130:e1600– 6. doi: 10.1542/peds.2011-3634
-
Deshmukh M, Balasubramanian H, Patole S. Meconium evacuation for facilitating feed tolerance in preterm neonates: a systematic review and metaanalysis.
Neonatology. (2016) 110:55–65. doi: 10.1159/000444075 -
Bell EF, Acarregui MJ. Restricted vs. liberal water intake for preventing morbidity and mortality in preterm infants. Cochrane Database Syst Rev. (2014) CD000503. doi: 10.1002/14651858.CD000503.pub3
-
Wada M, Kusuda S, Takahashi N, Nishida H. Fluid and electrolyte balance in extremely preterm infants <24 weeks of gestation in the 1st week of life. Pediatr Int. (2008) 50:331–6. doi: 10.1111/j.1442-200X.2008.02577.x
-
Todd DA, Wright A, Smith J, NICUS Group. Severe retinopathy of prematurity in infants<30 weeks’ gestation in New South Wales and the Australian Capital Territory from 1992 to 2002. Arch Dis Child Fetal Neonatal Ed. (2007) 92:F251–4. doi: 10.1136/adc.2006.096479
-
Darlow BA, Hutchinson JL, Henderson-Smart DJ, Donoghue DA, Simpson JM, Evans NJ, et al. Prenatal risk factors for severe retinopathy of prematurity among very preterm infants of the Australian and New Zealand Neonatal Network. Pediatrics. (2005) 115:990–6. doi: 10.1542/peds.2004-1309
-
Seiberth V, Linderkamp O. Risk factors in retinopathy of prematurity. A multivariate statistical analysis. Ophthalmologica. (2000) 214:131–5. doi: 10.1159/000027482
-
Simons SH, van Dijk M, Anand KS, Roofthooft D, van Lingen RA, Tibboel D. Do we still hurt newborn babies? A prospective study of procedural pain and analgesia in neonates. Arch Pediatr Adolesc Med. (2003) 157:1058– 64. doi: 10.1001/archpedi.157.11.1058
-
Carbajal R, Rousset A, Danan C, Coquery S, Nolent P, Ducrocq S, et al. Epidemiology and treatment of painful procedures in neonates in intensive care units. JAMA. (2008) 300:60–70. doi: 10.1001/jama.300.1.60
-
Cignacco E, Hamers J, van Lingen RA, Stoffel L, Buchi S, Muller R, et al. Neonatal procedural pain exposure and pain management in ventilated preterm infants during the first 14 days of life. Swiss Med Wkly. (2009) 139:226–32.
-
Jeong IS, Park SM, Lee JM, Choi YJ, Lee J. The frequency of painful procedures in neonatal intensive care units in South Korea. Int J Nurs Pract. (2014) 20:398–407. doi: 10.1111/ijn.12202
-
Itabashi K, Miura F, Uehara R, Nakamura Y. New Japanese neonatal anthropometric charts for gestational age at birth. Pediatr Int. (2014) 56:702– 8. doi: 10.1111/ped.12331
-
BBC News. “Tiniest baby boy” ever sent home leaves Tokyo hospital. (2019) Available online at: https://www.bbc.com/news/world-asia-47382058?ocid=
socialflow_twitter (accessed December 15, 2020). -
Ehret D, Edwards EM, Greenberg LT, Bernstein IM, Buzas JS, Soll RF, et al. Association of antenatal steroid exposure with survival among infants receiving postnatal life support at 22 to 25 weeks’ gestation. JAMA Netw Open. (2018) 1:e183235. doi: 10.1001/jamanetworkopen.2018.3235
-
Pergialiotis V, Bellos I, FanakiM, Antsaklis A, Loutradis D, Daskalakis G. The impact of residual oligohydramnios following preterm premature rupture of
membranes on adverse pregnancy outcomes: a meta-analysis. Am J Obstet Gynecol. (2020) 222:628–30. doi: 10.1016/j.ajog.2020.02.022 -
Soraisham AS, Singhal N, McMillan DD, Sauve RS, Lee SK, Canadian Neonatal Network. A multicenter study on the clinical outcome of chorioamnionitis in preterm infants. Am J Obstet Gynecol. (2009) 200:372.e1– 6. doi: 10.1016/j.ajog.2008.11.034
-
Anderson JG, Baer RJ, Partridge JC, KuppermannM, Franck LS, Rand L, et al. Survival and major morbidity of extremely preterm infants: a populationbased study. Pediatrics. (2016) 138:e20154434. doi: 10.1542/peds.2015-4434
-
Guedj R, Danan C, Daoud P, Zupan V, Renolleau S, Zana E, et al. Does neonatal pain management in intensive care units differ between night and day? An observational study. BMJ Open. (2014) 4:e004086. doi: 10.1136/bmjopen-2013-004086
-
Britto CD, Rao Pn S, Nesargi S, Nair S, Rao S, Thilagavathy T, et al. PAIN– perception and assessment of painful procedures in the NICU. J Trop Pediatr.
(2014) 60:422–7. doi: 10.1093/tropej/fmu039 -
Roofthooft DW, Simons SH, Anand KJ, Tibboel D, van Dijk M. Eight years later, are we still hurting newborn infants? Neonatology. (2014) 105:218– 26. doi: 10.1159/000357207